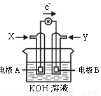
题目内容
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液)。下列叙述不正确的是
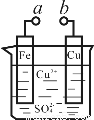
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铁片上发生的反应为:Fe-3e- = Fe3+
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动
B
【解析】
试题分析:A.a和b不连接时,由于Fe比Cu活泼。所以在溶液中发生反应:Fe+CuSO4=FeSO4+Cu。铁片上会有金属铜析出。正确。B.a和b用导线连接时,则构成了原电池。Fe作负极,Cu作正极。铁片上发生的反应为:Fe-2e- = Fe2+。错误。C.由A、B的分析不难发现:无论a和b是否连接,铁片均会溶解,溶液的蓝色逐渐变浅。正确。D.若a和b分别连接直流电源正、负极,则a为阳极,b为阴极。根据同种电荷相互排斥,异种电荷相互吸引的原则。Cu2+向负电荷较多的铜电极移动,SO42-向铁电极移动。正确。
考点:考查电化学原理的知识。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目