题目内容
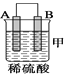
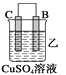
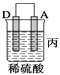
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________mol
(3)装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________。
【答案】B Cu2++2e-==Cu 0.4 还原反应 D>A>B>C
【解析】
(1)甲装置中,金属A不断溶解,说明A是负极,B是正极,故答案为:B。
(2)乙装置中,C的质量不断增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应式是Cu2++2e-==Cu,反应一段时间后,测得C电极的质量增加12.8克,即生成铜的物质的量为12.8g÷64g/mol=0.2mol,根据电极方程式可知转移电子的物质的量为0.2mol×2=0.4mol,故答案为:Cu2++2e-==Cu,0.4。
(3)丙装置中A电极上有气体生成,所以A电极是正极,溶液中的氢离子得电子发生还原反应生成氢气,故答案为:还原反应。
(4)甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活泼性由强到弱的顺序是D>A>B>C,故答案为:D>A>B>C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目