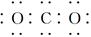题目内容
高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。

请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。

请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
(1)Cu2S+O2(适量) 2Cu+SO2 O2和Cu2S
2Cu+SO2 O2和Cu2S
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)粗铜 硫酸铜或含Cu2+的盐溶液
(4)3∶7
 2Cu+SO2 O2和Cu2S
2Cu+SO2 O2和Cu2S(2)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O(3)粗铜 硫酸铜或含Cu2+的盐溶液
(4)3∶7
(1)根据图示,Cu2S与O2的反应为氧化还原反应,结合B与O2的反应条件,可以推断B为SO2,该反应为Cu2S+O2(适量) 2Cu+SO2。反应中Cu、O的化合价降低,因此氧化剂为O2和Cu2S。(2)B为SO2,则D为SO3,E为H2SO4。反应②为Cu+2H2SO4(浓)
2Cu+SO2。反应中Cu、O的化合价降低,因此氧化剂为O2和Cu2S。(2)B为SO2,则D为SO3,E为H2SO4。反应②为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。(3)电解精炼铜时,粗铜作阳极,含Cu2+的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
CuSO4+SO2↑+2H2O。(3)电解精炼铜时,粗铜作阳极,含Cu2+的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
 2Cu+SO2。反应中Cu、O的化合价降低,因此氧化剂为O2和Cu2S。(2)B为SO2,则D为SO3,E为H2SO4。反应②为Cu+2H2SO4(浓)
2Cu+SO2。反应中Cu、O的化合价降低,因此氧化剂为O2和Cu2S。(2)B为SO2,则D为SO3,E为H2SO4。反应②为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。(3)电解精炼铜时,粗铜作阳极,含Cu2+的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
CuSO4+SO2↑+2H2O。(3)电解精炼铜时,粗铜作阳极,含Cu2+的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
练习册系列答案
相关题目
 H2SO3
H2SO3 Fe2O4+4H2
Fe2O4+4H2

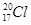
 CO32-+H3O+
CO32-+H3O+