题目内容
【题目】已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJmol﹣1
2H2(g)+O2(g)═2H2O(g);△=﹣Q2 kJmol﹣1 ,
2H2(g)+O2(g)═2H2O(l);△H2=﹣Q3 kJmol﹣1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2
B.0.2Q1+0.05Q2
C.0.2Q1+0.15Q3
D.0.2Q1+0.3Q2
【答案】C
【解析】标准状况下11.2L甲烷和氢气混合气体的物质的量为 ![]() =0.5mol,甲烷和氢气的体积之比为2:3,所以甲烷的物质的量为:0.5mol×
=0.5mol,甲烷和氢气的体积之比为2:3,所以甲烷的物质的量为:0.5mol× ![]() =0.2mol,氢气的物质的量为0.5mol﹣0.2mol=0.3mol,
=0.2mol,氢气的物质的量为0.5mol﹣0.2mol=0.3mol,
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJmol﹣1 可知,0.2mol甲烷燃烧放出的热量为0.2mol×Q1 kJmol﹣1=0.2Q1 kJ,由2H2(g)+O2(g)═2H2O(l)△H3=﹣Q3kJmol﹣1可知,0.3mol氢气燃烧放出的热量为 ![]() ×Q3kJmol﹣1=0.15Q3kJ,所以放出的热量为0.2Q1kJ+0.15Q3kJ=(0.2Q1+0.15Q3)kJ,
×Q3kJmol﹣1=0.15Q3kJ,所以放出的热量为0.2Q1kJ+0.15Q3kJ=(0.2Q1+0.15Q3)kJ,
故答案为:C.
反应放出的总热量为各燃料放出的热量之和。

【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,SO2与O2反应5min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为______;用SO3表示这段时间该化学反应速率为_______。
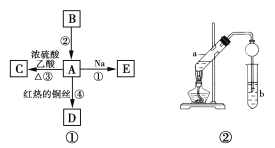
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从____处通入(填“a”或b”),电池内部H+向_____(填“左”或“右”)移动。写出正极的电极反应式________。

(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N—H | N≡N |
键能kJ/mol | 436 | a | 945 |
已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。