题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素,霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
Ⅰ. 2NO(g)+O2(g)![]() 2NO2(g) H=-113.0 kJ mol-1
2NO2(g) H=-113.0 kJ mol-1
Ⅱ. 2SO2(g)+O2(g)![]() 2SO3(g) H=-196.6 kJ mol-1
2SO3(g) H=-196.6 kJ mol-1
二氧化硫通常在二氧化氮的存在下,进一步被氧化,生成三氧化硫。
①写出NO2和SO2反应的热化学方程式为______。
②反应Ⅱ自发进行的条件是______(填“较高温”“较低温”或“任何温度”)。
(2)提高2SO2(g)+O2(g) ![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是______。
②在①中条件下,反应达到平衡后改变下列条件,能使SO2的转化率提高的是______(填字母)。
a.温度和容器体积不变,充入1.0mol He
b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
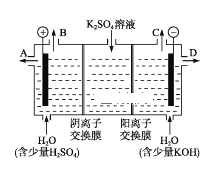
(3)电解NO制备NH4NO3,其工作原理如图所示。阳极的电极反应式为_____________________________,为使电解产物全部转化为NH4NO3,需补充物质是_____。

【答案】SO2(g)+NO2(g)![]() SO3(g)+NO(g) H= -41.8 kJ mol-1 较低温 4 b c NO - 3e- + 2H2O = NO3- + 4H+ NH3
SO3(g)+NO(g) H= -41.8 kJ mol-1 较低温 4 b c NO - 3e- + 2H2O = NO3- + 4H+ NH3
【解析】
(1) ①Ⅰ. 2NO(g)+O2(g)![]() 2NO2(g) H=-113.0 kJ mol-1,Ⅱ. 2SO2(g)+O2(g)
2NO2(g) H=-113.0 kJ mol-1,Ⅱ. 2SO2(g)+O2(g)![]() 2SO3(g) H=-196.6 kJ mol-1,根据盖斯定律分析,有(Ⅱ-Ⅰ)/2得热化学方程式为: SO2(g)+NO2(g)
2SO3(g) H=-196.6 kJ mol-1,根据盖斯定律分析,有(Ⅱ-Ⅰ)/2得热化学方程式为: SO2(g)+NO2(g)![]() SO3(g)+NO(g) H=(-196.6kJ/mol+113.0kJ/mol)/2= -41.8 kJ mol-1 。 ② 反应Ⅱ为放热反应,熵减,根据△G=△H-T△S分析,所以该反应在低温自发进行。(2)
SO3(g)+NO(g) H=(-196.6kJ/mol+113.0kJ/mol)/2= -41.8 kJ mol-1 。 ② 反应Ⅱ为放热反应,熵减,根据△G=△H-T△S分析,所以该反应在低温自发进行。(2)
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
起始物质的量浓度 1.0 0.5 0
改变物质的量浓度 0.5 0.25 0.5
平衡时物质的量浓度0.5 0.25 0.5
则平衡常数为![]() =4。 ②a.温度和容器体积不变,充入1.0mol He,平衡不移动,不能提高二氧化硫的转化率,故错误;b.温度和容器体积不变,充入1.0mol O2,平衡正向移动,提高二氧化硫的转化率,故正确;c.在其他条件不变时,减少容器的体积,相当于加压,平衡正向移动,提高二氧化硫的转化率,故正确;d.在其他条件不变时,改用高效催化剂,平衡不移动,不能提高转化率,故错误;e.在其他条件不变时,升高体系温度,平衡逆向移动,二氧化硫的转化率降低,故错误。故选b c。 (5)从图分析,一氧化氮分别变为铵根离子和硝酸根离子,一氧化氮在阳极失去电子,化合价升高,所以生成硝酸根离子,电极反应为: NO - 3e- + 2H2O = NO3- + 4H+ ,根据电子守恒分析,一氧化氮转化为硝酸根离子失去3个电子,一氧化氮转化为铵根离子得到5个电子,所以反应过程中生成的硝酸根离子比铵根离子多,为了生成硝酸铵,所以需要通入氨气。
=4。 ②a.温度和容器体积不变,充入1.0mol He,平衡不移动,不能提高二氧化硫的转化率,故错误;b.温度和容器体积不变,充入1.0mol O2,平衡正向移动,提高二氧化硫的转化率,故正确;c.在其他条件不变时,减少容器的体积,相当于加压,平衡正向移动,提高二氧化硫的转化率,故正确;d.在其他条件不变时,改用高效催化剂,平衡不移动,不能提高转化率,故错误;e.在其他条件不变时,升高体系温度,平衡逆向移动,二氧化硫的转化率降低,故错误。故选b c。 (5)从图分析,一氧化氮分别变为铵根离子和硝酸根离子,一氧化氮在阳极失去电子,化合价升高,所以生成硝酸根离子,电极反应为: NO - 3e- + 2H2O = NO3- + 4H+ ,根据电子守恒分析,一氧化氮转化为硝酸根离子失去3个电子,一氧化氮转化为铵根离子得到5个电子,所以反应过程中生成的硝酸根离子比铵根离子多,为了生成硝酸铵,所以需要通入氨气。

 目标测试系列答案
目标测试系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为________。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c(OH-)/ c(H+) E.c(H+)c(CH3COO-)/ c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:

则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是____________________。
(4)已知100℃时,水的离子积为1×10﹣12, 该温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。