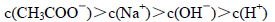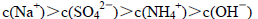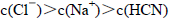题目内容
下列叙述正确的是(设NA为阿伏加德罗常数的数值)
| A.检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 |
| B.铅蓄电池放电时的负极反应式为:PbO2+4H++SO42一+2e一=PbSO4+2H2O |
| C.Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 |
| D.某电池的总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
D
试题分析:A、亚铁离子具有还原性,所以检验溶液中是否含有Fe2+的方法是先滴加KSCN溶液无现象,再滴加氯水,溶液变成红色,A不正确;B、原电池中负极失去电子,正极得到电子,所以铅蓄电池放电时的正极反应式为PbO2+4H++SO42一+2e一=PbSO4+2H2O。负极反应式为Pb-2e-+SO42-=PbSO4,B不正确;C、碳酸钠溶于水CO32-水解,溶液显碱性。稀释促进水解,但溶液的pH降低。温度不变,Kw不变,C不正确;D、根据反应式可知,二氧化锰是氧化剂,银是还原剂,化合价从0价升高到+1价,所以每生成lmolNa2Mn5O10转移电子数2NA,D正确,答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 浓度最大的是( )
浓度最大的是( )