题目内容
下列物质所配成的0.1mol/L溶液中,离子浓度由大到小顺序排列正确的( )
| A、NH4Cl:(Cl-)>(H+)>(NH4+)>(OH-) |
| B、Na2CO3:(Na+)>(CO32-)>(HCO3-)>(OH-)>(H+) |
| C、NaHCO3:(Na+)>(CO32-)>(HCO3-)>(OH-)>(H+) |
| D、(NH4)2SO4:(NH4+)>(SO42-)>(H+)>(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.氯化铵溶液中,铵根离子部分水解,溶液显示酸性,但是离子浓度应该为c(H+)<c(NH4+);
B.碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性,由于水中含有水电离的氢氧根离子,则c(OH-)>c(HCO3-);
C.碳酸氢钠溶液中,碳酸氢根离子只是很少的部分水解,则c(HCO3-)>c(CO32-);
D.硫酸铵溶液中,铵根离子部分水解,溶液显示酸性,由于铵根离子只是部分水解,溶液中一定满足:c(NH4+)>c(SO42-).
B.碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性,由于水中含有水电离的氢氧根离子,则c(OH-)>c(HCO3-);
C.碳酸氢钠溶液中,碳酸氢根离子只是很少的部分水解,则c(HCO3-)>c(CO32-);
D.硫酸铵溶液中,铵根离子部分水解,溶液显示酸性,由于铵根离子只是部分水解,溶液中一定满足:c(NH4+)>c(SO42-).
解答:
解:A.氯化铵溶液中,铵根离子发生水解的物质的量较小,溶液中离子浓度大小为c(H+)<c(NH4+),正确的离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.碳酸钠溶液中,由于溶液中氢氧根离子来自碳酸根离子的水解和水的电离,所以c(OH-)>c(HCO3-),溶液中正确的浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B错误;
C.碳酸氢钠溶液中,碳酸氢根离子参与水解的部分很小,则溶液中c(HCO3-)>c(CO32-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.硫酸铵溶液中,铵根离子部分水解,溶液显示酸性,在溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确;
故选D.
B.碳酸钠溶液中,由于溶液中氢氧根离子来自碳酸根离子的水解和水的电离,所以c(OH-)>c(HCO3-),溶液中正确的浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B错误;
C.碳酸氢钠溶液中,碳酸氢根离子参与水解的部分很小,则溶液中c(HCO3-)>c(CO32-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.硫酸铵溶液中,铵根离子部分水解,溶液显示酸性,在溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确;
故选D.
点评:本题考查了盐的水解原理、溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,能够利用电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.

练习册系列答案
相关题目
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
| A、230Th的中子数比核外电子数多140 |
| B、230Th和232Th的化学性质相同 |
| C、232Th转换成233U是化学变化 |
| D、Th元素的相对原子质量是231 |
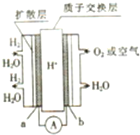 某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )
某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )| A、a极为该电池的负极 |
| B、该电池的正极反应式为O2+4e-+2H2O=4OH- |
| C、多孔活性铂电极有利于吸附气体,增大接触面积 |
| D、H+(质子)由负极移向正极 |
氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池.氢镍电池的总反应为
H2+NiO(OH)
Ni(OH)2,据此判断,下列叙述中正确的是( )
| 1 |
| 2 |
| 放电 |
| 充电 |
| A、电池放电时,H2是正极 |
| B、电池放电时,镍元素被氧化 |
| C、电池充电时,氢元素被还原 |
| D、电池放电时,电池负极周围溶液的pH不断增大 |
如图是某种微粒的结构示意图,x为( )


| A、8 | B、10 | C、11 | D、无法确定 |
下列离子方程式,正确的是( )
| A、在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O |
| B、碳酸钠溶液中加入二氧化硅:CO32-+SiO2═SiO32-+CO2↑ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
下面有关硅的叙述中,正确的是( )
| A、光导纤维是以硅酸盐为主要原料制成的 |
| B、硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 |
| C、硅的化学性质不活泼,在自然界中可以以游离态存在 |
| D、硅在电子工业中,是最重要的半导体材料 |
如图所示能够组成原电池,并且产生明显的电流的是( )
A、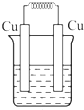 稀硫酸 |
B、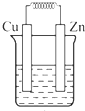 稀硫酸 |
C、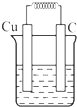 CuSO4 |
D、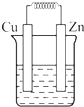 ZnSO4 |
下列关于有机物的说法正确的是( )
| A、苯乙烯分子中所有原子可能在同一个平面上 |
| B、分子式为C7H8O且分子中有苯环有机物共有4种 |
| C、乙醇和甘油互为同系物 |
| D、除去乙醇中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 |