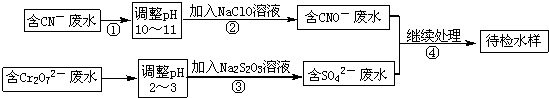
题目内容
20.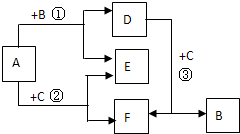 A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质.
A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质.(1)若B、C、E都是同主族非金属单质,则B、C、E三者的 氧化性由强到弱的顺序是(用化学式表示)Cl2>Br2>I2;反应③的离子方程式是Cl2+2Br-=2Cl-+Br2.
(2)若B、C都是化合物,则E的分子式是O2,反应①中每生成1molE转移电子的物质的量是2mol,该反应的化学方程式并标出电子转移的方向和数目是:
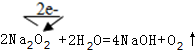 .
.(3)若B是日常生活中常见金属单质,C是非金属单质,且反应①②③均在高温下进行.则E的分子式是H2,反应①的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
分析 (1)若B、C、E都是同主族非金属单质,则反应①、②、③为置换反应,E为I2,B为Br2,C为Cl2,A、D、F为对应的化合物;
(2)化合物A和化合物B、C反应都生成单质E,且E为非金属性单质,可为O2,则A为2Na2O2,由转化可知B为H20,C为CO2,D为NaOH,F为Na2CO3;
(3)若B是日常生活中常见金属单质,C是非金属单质,且反应①②③均在高温下进行,则A为H2O,B为Fe,C为C单质,D为Fe3O4,E为H2,F为CO.
结合对应物质的性质以及题目要求可解答该题.
解答 解:(1)若B、C、E都是同主族非金属单质,则反应①、②、③为置换反应,E为I2,B为Br2,C为Cl2,A、D、F为对应的化合物,B、C、E三者的氧化性由强到弱的顺序是Cl2>Br2>I2,反应③的离子方程式是Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2>Br2>I2;Cl2+2Br-=2Cl-+Br2;
(2)化合物A和化合物B、C反应都生成单质E,且E为非金属性单质,可为O2,则A为2Na2O2,由转化可知B为H20,C为CO2,D为NaOH,F为Na2CO3,过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠中O元素化合价由-1价变为-2价和0价,其电子转移方向和数目为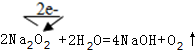 ,每生成1molO2转移电子的物质的量是2mol,
,每生成1molO2转移电子的物质的量是2mol,
故答案为:O2;2mol;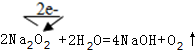 ;
;
(3)若B是日常生活中常见金属单质,C是非金属单质,且反应①②③均在高温下进行,则A为H2O,B为Fe,C为C单质,D为Fe3O4,E为H2,F为CO,反应①的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:H2;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查了氧化还原反应,熟悉元素化合价是解本题关键,注意过氧化钠中O元素化合价,题目难度中等.

| A. | NF3中N呈+3价 | B. | NF3的还原性比NH3强 | ||
| C. | NF3的氧化性比F2强 | D. | NF3是离子化合物 |
| A. | 氨水 | B. | Ba(OH)2 溶液 | C. | 盐酸 | D. | NaOH溶液 |
| A. | 使用火药 | B. | 用粮食酿酒 | C. | 用纺线车纺线 | D. | 铁的冶炼 |
| A. | 1 L 0.1 mol/L的氨水中有NA个NH${\;}_{4}^{+}$ | |
| B. | 常温常压下,8 gO2含有4NA个电子 | |
| C. | 标准状况下,22.4 L三氯甲烷含有NA个分子 | |
| D. | 1 mol Na被完全氧化生成Na2O2,失去2NA电子 |
| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:NH4+、CH3COO-、SO42-、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
| 选项 | 事 实 | 解 释 |
| A | 墙内开花墙外可嗅到花香 | 分子不断运动 |
| B | 酒精溶液是混合物 | 由不同种分子构成 |
| C | 水结冰后体积变大 | 水分子体积变大 |
| D | 氢氧化钠溶液能导电 | 溶液中存在自由移动的Na+和OH- |
| A. | A | B. | B | C. | C | D. | D |