题目内容
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示,下列说法正确的是
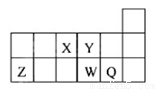
A. 离子Y2-和Z3+的核外电子数和电子层数都不相同
B. 原子半径的大小顺序为rX>rY>rZ>rW>rQ
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
 名校课堂系列答案
名校课堂系列答案SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。

(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)

操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |
用石墨作电极完全电解含1 mol溶质X的溶液后,向溶液中加入一定量的物质Y能使电解液恢复到起始状态是
选项 | X溶液 | 物质Y |
A | CuCl2 | 1 mol Cu(OH)2 |
B | KOH | 1 mol KOH |
C | Na2SO4 | 1 mol H2SO4 |
D | AgNO3 | 0.5 mol Ag2O |
A. A B. B C. C D. D



 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
