题目内容
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
①用物质A 表示的反应的平均速率为0.3 mol·L-1·S-1
②用物质B 表示的反应的平均速率为0.6 mol·L-1·S-1
③2 s 时物质A 的转化率为70%
④2 s 时物质B 的浓度为0.7 mol·L-1,
| A.①③ | B.①④ | C.②③ | D.③④ |
B
解析

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH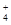 )之和 )之和 |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
| A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 |
| D.0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
下列叙述不正确的是
| A.向纯水中加入少量CH3COONa固体,促进了水的电离 |
| B.25°C 时,pH=3的醋酸与pH=3的HCl对水的电离抑制作用相同 |
| C.25°C时,pH=3的NH4Cl溶液中,水电离出的c(H+)是10-3mol/L |
| D.升高温度,纯水电离出的c(H+)增大,pH减少,显酸性 |
有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序③>①>② |
已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A.所得溶液中的c(H+)=1.0×10-13mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液pH=13 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
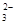 )+c(HCO
)+c(HCO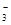 )]
)]