题目内容
8.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)=c(Na+) |
分析 A.氢离子和氢氧根离子反应生成水,钠离子不参加反应,则:c(Na+)>c(OH-);
B.任何电解质溶液都存在电荷守恒;
C.常温下,pH<7,则氢离子浓度大于氢氧根离子;
D.常温下pH=7,说明溶液呈中性,根据电荷守恒判断.
解答 解:A.氢离子和氢氧根离子反应生成水,钠离子不反应,则c(Na+)>c(OH-)、c(H+)<c(CH3COO-),故A错误;
B.任何电解质溶液都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故B正确;
C.常温下,pH<7,说明溶液呈酸性,则c(OH-)<c(H+),若醋酸远远过量,则可以满足:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故C正确;
D.常温下pH=7,说明溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知:c(CH3COO-)=c(Na+),故D正确;
故选A.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中应用方法.

练习册系列答案
相关题目
15.填写下面的表格,从这些数据中得出有用的结论:
结论:当质量以g为单位时,
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
19.在水溶液中能大量共存的离子组是( )
| A. | Al3+ H+ HCO3- | B. | Na+ NO3- Cl- | C. | H+ OH- SO42- | D. | Ca2+ K+ CO32- |
16.丙烷(C3H8)的二氯代物有4种,则其六氯代物有( )种.
| A. | 5 | B. | 2 | C. | 3 | D. | 4 |
3. (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
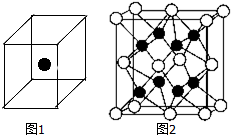
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
20.下列反应中,既是离子反应,又是氧化还原反应的是( )
| A. | CaCO3+HCl | B. | Ag NO3+NaCl | C. | Fe+CuSO4 | D. | NaOH+H2SO4 |