题目内容
【题目】北京时间2017年10月4日,地球发生一次小行星撞击事件,撞击地点为我国云南香格里拉县城西北40公里处,爆炸当量相当于540t TNT。很可能有未燃尽的陨石落到地面。全世界已收集到4万多块陨石样品,它们大致可分为三大类:石陨石(主要成分是硅酸盐)、铁陨石(铁镍合金)、和石铁陨石(铁和硅酸盐混合物)。

回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]_______。
(2)TNT的结构简式如图所示。

①TNT分子中碳原子杂化类型是____。
②TNT的熔点比硝基苯的熔点__(填“高”或“低”),理由是___。
(3)石陨石中硅酸盐之一是Ca2SiO4。
SiO44-的立体构型是_____。电负性:Si___(填“>”“<”或“=”)O。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有__(填字母)。
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol [Fe(CN)6]3含σ键数目为_____。
③CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是___。
(5)铁、氮组成磁材料M,其晶胞如图所示。该晶体中氮、铁原子个数之比为____。

(6)镍晶体的堆积方式为面心立方最密堆积。已知镍晶体密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。用含ρ和NA的代数式表示在镍晶胞中最近的两个镍原子之间的核间距D=__nm。
【答案】3d64s2 sp2、sp3 高 组成、结构相似,TNT的相对分子质量较大,分子间作用力较大 正四面体 < c、f 12NA C的原子半径大于N的,提供孤电子对的能力比N强 1∶3 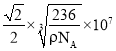
【解析】
(1)铁为26号元素,结合核外电子排布的规律分析书写基态铁原子的电子排布式;
(2)①TNT分子中存在2中碳原子:苯环上的碳原子和甲基中的碳原子,据此分析判断;②组成、结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔点越高,据此分析判断;
(3)根据价层电子对个数=σ键个数+![]() (a-xb)分析判断SiO44-的立体构型;元素的非金属性越强,电负性越大;
(a-xb)分析判断SiO44-的立体构型;元素的非金属性越强,电负性越大;
(4)①K3[Fe(CN)6](铁氰化钾)中存在离子键、配位键和极性共价键,![]() 中还存在π键;②
中还存在π键;②![]() 中存在2个π键,1个σ键,配位键是σ键;③配位原子需要具备两个条件:一是有孤电子对,二是原子半径较大,容易提供孤电子对,据此分析解答;
中存在2个π键,1个σ键,配位键是σ键;③配位原子需要具备两个条件:一是有孤电子对,二是原子半径较大,容易提供孤电子对,据此分析解答;
(5)M晶胞是六方最密堆积,顶点贡献率为![]() ,面心贡献率为
,面心贡献率为![]() ,结合均摊法分析解答;
,结合均摊法分析解答;
(6)根据均摊法计算镍原子数,面心立方晶胞中面对角线上3个镍原子相切,面对角线长度等于镍原子半径的4倍,据此分析解答。
(1)铁为26号元素,基态铁原子简化的电子排布式为[Ar] 3d64s2,故答案为:3d64s2;
(2)①TNT分子中苯环上的碳原子采用sp2杂化,甲基中的碳原子采用sp3杂化,故答案为:sp2、sp3;
②组成、结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔点越高,TNT的相对分子质量较大,分子间作用力较大,因此TNT的熔点比硝基苯的熔点高,故答案为:高;组成、结构相似,TNT的相对分子质量较大,分子间作用力较大;
(3)SiO44-中Si的价层电子对数=4+![]() =4,没有孤电子对,立体构型为正四面体。O的非金属性比硅强,因此电负性:Si<O,故答案为:正四面体;<;
=4,没有孤电子对,立体构型为正四面体。O的非金属性比硅强,因此电负性:Si<O,故答案为:正四面体;<;
(4)①K3[Fe(CN)6](铁氰化钾)中存在离子键、配位键和极性共价键,![]() 中还存在π键,不存在非极性键和氢键,故答案为:c、f;
中还存在π键,不存在非极性键和氢键,故答案为:c、f;
②![]() 中存在2个π键,1个σ键,配位键是σ键,故1mol [Fe(CN)6]3含σ键12mol,数目为12NA,故答案为:12NA;
中存在2个π键,1个σ键,配位键是σ键,故1mol [Fe(CN)6]3含σ键12mol,数目为12NA,故答案为:12NA;
③配位原子需要具备两个条件:一是有孤电子对,二是原子半径较大,容易提供孤电子对。C的原子半径大于N的,提供孤电子对的能力比N强,因此形成配位键时,CN-中碳原子提供孤电子对,而不是氮原子,故答案为:C的原子半径大于N的,提供孤电子对的能力比N强;
(5)M晶胞是六方最密堆积,顶点贡献率为![]() ,面心贡献率为
,面心贡献率为![]() ,1个M晶胞含有2个N原子,铁原子数=12×
,1个M晶胞含有2个N原子,铁原子数=12×![]() +2×
+2×![]() +3=6,该晶体中氮、铁原子个数之为2∶6=1∶3,故答案为:1∶3;
+3=6,该晶体中氮、铁原子个数之为2∶6=1∶3,故答案为:1∶3;
(6)面心立方晶胞中含有镍原子数=8×![]() +6×
+6×![]() =4,晶胞中面对角线上3个镍原子相切,面对角线长度等于镍原子半径的4倍。1cm=1×107nm,设镍晶胞的边长为x,则ρ=
=4,晶胞中面对角线上3个镍原子相切,面对角线长度等于镍原子半径的4倍。1cm=1×107nm,设镍晶胞的边长为x,则ρ=![]() ,x=
,x=![]() cm=
cm=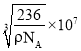 nm,(2D)2=x2,D=
nm,(2D)2=x2,D=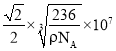 nm,故答案为:
nm,故答案为: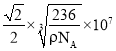 。
。