题目内容
正确选择实验材料,是得出正确结论的前提。下列有关实验材料的选择,正确的是
| 实验名称 | 取材部位 | |
| A. B. C. D. | 可溶性还原糖的鉴定 提取并研究细胞膜的化学组成 观察细胞的质壁分离和复原 观察植物细胞的有丝分裂 | 甘蔗、甜菜的块根 公鸡的成熟红细胞 紫色洋葱鳞片叶表皮细胞 洋葱根尖根毛区细胞 |
C
解析:
略

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
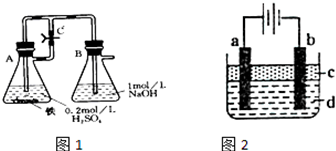 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:【实验设计】
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行.最终在
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀.请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色 Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2?nH2O所致.用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势.加热时,“方法一”中弹簧夹C应处于
 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案: