题目内容
(2009?泰州模拟)缓冲溶液可以控制少量酸碱对溶液pH的影响,NaH2PO4/Na2HPO4的混合溶液可以将体系的pH稳定在6.2~8.2.下列有关该缓冲溶液的说法正确的是( )
分析:NaH2PO4/Na2HPO4的混合溶液中存在和H2PO4-?HPO42-+H+,HPO42-+H2O?H2PO4-+OH-,加入酸可与HPO42-反应,加入碱可与H2PO4-反应,以此维持溶液的pH的稳定,结合溶液的电荷守恒和物料守恒解答该题.
解答:解:A.加入少量强碱,发生反应H2PO4-+OH-═HPO42-+H2O,故A错误;
B.加入少量强酸,发生反应HPO42-+H+═H2PO4-,维持溶液的pH的稳定,故B正确;
C.溶液呈电中性,即阴阳离子所带电荷总数相等,存在c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),故C错误;
D.当溶液为时Na2HPO4,2[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=c(Na+),当为NaH2PO4时,c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)=c(Na+),则c(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>
c(Na+),故D错误.
故选B.
B.加入少量强酸,发生反应HPO42-+H+═H2PO4-,维持溶液的pH的稳定,故B正确;
C.溶液呈电中性,即阴阳离子所带电荷总数相等,存在c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),故C错误;
D.当溶液为时Na2HPO4,2[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=c(Na+),当为NaH2PO4时,c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)=c(Na+),则c(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>
| 1 |
| 2 |
故选B.
点评:本题考查离子浓度大小比较,题目难度中等,注意把握缓冲溶液的特点,从弱电解质的电离和盐类水解的角度分析该类题目,注意电荷守恒、物料守恒的运用.

练习册系列答案
相关题目
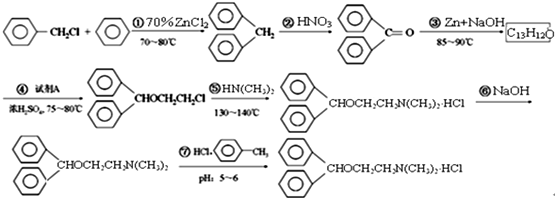
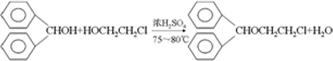

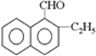
 由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得:
由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得: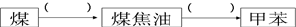 请在括号中填写加工方法或操作名称
请在括号中填写加工方法或操作名称 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.