题目内容
【题目】某学习小组用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备Fe3O4纳米材料的流程示意图如下:
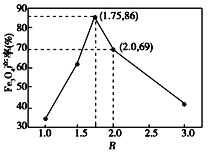
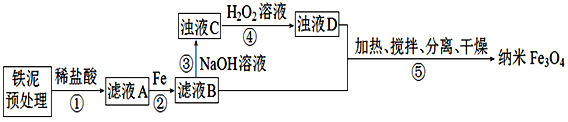
已知:步骤⑤中,相同条件下测得Fe3O4的产率与R(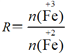 )的关系如图所示。
)的关系如图所示。
(1)为提高步骤①的反应速率,可采取的措施是_______________(任写一点) 。
(2)步骤②中,主要反应的离子方程式是________________________。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是___________________;步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是____________________________
(4)⑤反应的离子方程式为_________________ ;步骤⑤中的“分离”包含的步骤有______________________。
(5)设浊液D中FeOOH的物质的量为amol,滤液B中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,小数点后保留3位)
=_________。(填数值,小数点后保留3位)
【答案】 搅拌、适当升高温度 2Fe3+ + Fe = 3Fe2+ 2Fe(OH)2 +H2O2=2FeOOH + 2H2O 加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素 2FeOOH+Fe2++2OH-![]() Fe3O4+2H2O 过滤、洗涤 0.636
Fe3O4+2H2O 过滤、洗涤 0.636
【解析】(1)这是在溶液中进行的反应,为了提高反应速率,可采用搅拌,或适当升高温度,或者适当增大盐酸的浓度;
(2)由铁泥的主要成分为Fe2O3、FeO和少量Fe可知,在与盐酸反应后的滤液A中有FeCl3、FeCl2及剩余的HCl,所以加入铁粉后的反应有:2Fe3+ + Fe = 3Fe2+和Fe+2H+=Fe2++H2↑,其中主要的反应为2Fe3+ + Fe = 3Fe2+;
(3)浊液C为Fe(OH)2,而浊液D为FeOOH,所以步骤④的反应方程式为2Fe(OH)2 +H2O2
=2FeOOH + 2H2O,反应完成后继续加热,是为了除去H2O2,防止在与滤液B(即FeCl2)混合时氧化Fe2+;
(4)根据转化关系可知,步骤⑤中反应物为浊液D中的FeOOH和滤液B中的Fe2+,结合反应环境,可写出反应的离子方程式为2FeOOH+Fe2++2OH-![]() Fe3O4+2H2O;为了除去纳米Fe3O4中的浊液杂质,可用过滤、洗涤的方法进行分离;
Fe3O4+2H2O;为了除去纳米Fe3O4中的浊液杂质,可用过滤、洗涤的方法进行分离;
(5)已知浊液D中FeOOH的物质的量为amol,即Fe3+的物质的量为amol,滤液B中的铁元素的物质的量为bmol,则与浊液D中FeOOH反应的Fe2+的物质的量为(b-a)mol,由图象可知当Fe3O4的产率最高时,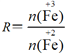 =1.75=
=1.75=![]() ,则
,则![]() =0.636。
=0.636。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】少量杂质(括号内为杂质),选用试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | 乙烷(乙烯) | (H+)KMnO4 | 洗气 |
B | 乙醇(H2O) | 新制CaO | 蒸馏 |
C | 苯(苯酚) | 溴水 | 过滤 |
D | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
A. A B. B C. C D. D
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
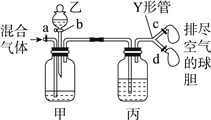
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
