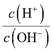题目内容
【题目】(1)漂白粉或漂粉精的有效成分是______(填化学式);
写出将氯气通入冷的消石灰中制取漂白粉的方程式____。
(2)![]() 的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
(3)________是制造光导纤维的重要原料,生产普通玻璃和水泥都用到的原料是__。
(4)NO2是______色有毒气体,NO2与水反应的方程式为___________,标准状况下67.2L NO2与水反应转移电子______mol。
(5)中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为:________________。
【答案】 Ca(ClO)2 2Ca(OH)2+2Cl2====CaCl2+Ca(ClO)2+2H2O 水玻璃 SiO2(或二氧化硅) 石灰石(或CaCO3) 红棕 3NO2+H2O=2HNO3+NO 2 Al2O3·2SiO2·2H2O
【解析】(1)漂白粉或漂粉精的有效成分是Ca(ClO)2;将氯气通入冷的消石灰中制取漂白粉的方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。(2)硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料。(3)SiO2是制造光导纤维的重要原料,生产普通玻璃和水泥都用到的原料是石灰石。(4)NO2是红棕色有毒气体,NO2与水反应的方程式为3NO2+H2O=2HNO3+NO,标准状况下67.2LNO2的物质的量是3mol,根据方程式可知氮元素从+4价降低到+2价,因此与水反应转移电子2mol。(5)根据化学式Al2Si2O5(OH)4可知若以氧化物形式表示黏土的组成,应写为Al2O3·2SiO2·2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】有机物A可用于制备常见的解热镇痛药阿司匹林.纯净的A为白色结晶性粉末,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为: . |
(2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为: . |
(3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱显示A有6种氢 | A的结构简式 |
(5)写出A与浓溴水反应的方程式: | |