题目内容
【题目】标出下列氧化还原反应中电子转移的方向和数目____________
![]()
该反应的还原产物是______________;____________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
【答案】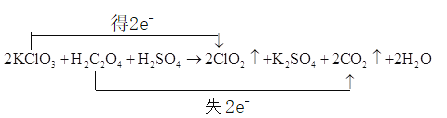 ClO2 碳 10
ClO2 碳 10
【解析】
![]() ,KClO3中Cl元素化合价由+5降低为+4;H2C2O4中C元素化合价由+3升高为+4。
,KClO3中Cl元素化合价由+5降低为+4;H2C2O4中C元素化合价由+3升高为+4。
![]() ,KClO3中Cl元素化合价由+5降低为+4;H2C2O4中C元素化合价由+3升高为+4,电子转移的方向和数目是
,KClO3中Cl元素化合价由+5降低为+4;H2C2O4中C元素化合价由+3升高为+4,电子转移的方向和数目是 ;KClO3中Cl元素化合价由+5降低为ClO2中+4,所以KClO3是氧化剂、还原产物是ClO2;H2C2O4中C元素化合价由+3升高为+4,所以C元素被氧化;根据方程式,
;KClO3中Cl元素化合价由+5降低为ClO2中+4,所以KClO3是氧化剂、还原产物是ClO2;H2C2O4中C元素化合价由+3升高为+4,所以C元素被氧化;根据方程式,![]() 电子发生转移,2mol KClO3被还原,若反应有
电子发生转移,2mol KClO3被还原,若反应有![]() 电子发生转移,则被还原的氧化剂是10mol。
电子发生转移,则被还原的氧化剂是10mol。

【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
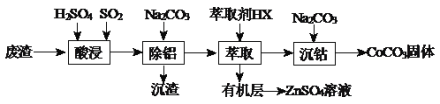
下表是相关金属离子生成氢氧化物沉淀的pH(按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸浸”时发生氧化还原反应的化学方程式________________________。
(2)“除铝”过程中需要调节溶液pH的范围为_________,形成沉渣时发生反应的离子方程式为______________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有_________________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________________。
(5)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视