题目内容
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是________________,其中表示平衡混合物中NH3的含量最高的一段时间是________,

若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1、K2、K3的大小关系是_______________
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“ 向右”或“不”),使用催化剂反应的ΔH_________(填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
【答案】 增大压强 t2-t3 K1=K2>K3 向左 不改变 ![]()
【解析】(1)由合成氨的热化学方程式可判断,该反应是放热反应,反应前后气体分子数减小;由图像可知,t1时正、逆反应速率都增大,平衡正向移动,所以引起平衡移动的条件可能是增大压强;t3时改变条件使平衡逆向移动、t5时改变条件平衡不移动,所以只有t1时改变条件使平衡正向移动,故平衡混合物中NH3的含量最高的一段时间是t2-t3;t3时改变条件正、逆反应速率都增大,平衡逆向移动,所以应该是升高温度,使平衡常数减小引起的变化,又因为其他各段没有改变温度,所以 K1=K2>K3。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,则体系的容积增大,与反应有关组分的分压减小,减小压强,平衡向气体分子数增大方向移动,所以平衡向左移动;催化剂只能改变反应速率,不影响化学平衡的移动,ΔH不改变。
(3)由题意列三段式:
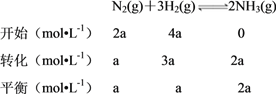
则反应的平衡常数为:K= =
=![]() =
=![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mo/L、0.15mol/L,则此时v正________v逆(填“>”、“=”或“<”)。

