题目内容
工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
(2)另取9.260g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136mL,则该固体的成分除(NH4)2SO3外还有______(填化学式),该实验中使用的硫酸的物质的量浓度为______.
第①组实验中的SO2体积与固体的质量之比,可以推算用6.945g该固体进行同样的实验时,产生SO2的体积为
 ×1344mL=1008mL;
×1344mL=1008mL;由数据可知第①组实验中固体完全反应由③④可知,增大固体的质量,产生二氧化硫的体积减小,说明④中盐过量,有一部分没有转化为二氧化硫,故盐中含有(NH4)2SO3,
故答案为:①②③;1008;③④;
(2)9.260g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136mL,9.260g固体中含有n(NH4+)=
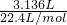 =0.14mol.第①组实验中生成的二氧化硫的体积为
=0.14mol.第①组实验中生成的二氧化硫的体积为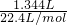 =0.06mol,第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3,故第④组中固体含S(生成二氧化硫)为
=0.06mol,第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3,故第④组中固体含S(生成二氧化硫)为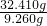 ×0.06mol=0.21mol,含有的NH4+为
×0.06mol=0.21mol,含有的NH4+为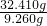 ×0.14mol=0.49mol,由于n(NH4+):n[S(生成二氧化硫)]:=0.49mol:0.21mol>2:1,故固体中含有(NH4)2SO4,若为(NH4)2SO3、(NH4)2SO4混合,则n[(NH4)2SO3]=0.21mol,所以n[(NH4)2SO4]=
×0.14mol=0.49mol,由于n(NH4+):n[S(生成二氧化硫)]:=0.49mol:0.21mol>2:1,故固体中含有(NH4)2SO4,若为(NH4)2SO3、(NH4)2SO4混合,则n[(NH4)2SO3]=0.21mol,所以n[(NH4)2SO4]=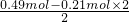 =0.035mol,二者质量之和为0.21mol×116g/mol+0.035mol×132g/mol=28.98g<32.410g,
=0.035mol,二者质量之和为0.21mol×116g/mol+0.035mol×132g/mol=28.98g<32.410g,故固体中还含有NH4HSO3,故原固体含有(NH4)2SO3、(NH4)2SO4、NH4HSO3;
设9.260 g固体中(NH4)2SO3、NH4HSO3、(NH4)2SO4的物质的量分别为x、y、z,则:
生成二氧化硫的物质的量为0.06mol,故x+y=0.06,
生成的氨气的物质的量为0.14mol,gu 2x+y+z=0.14,
三者的质量之和为9.26g,故116x+99y+132z=9.26 g,
联立方程解得:x=0.04 mol y=0.02 mol z=0.02 mol.
第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3,生成的二氧化硫为
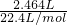 =0.11mol,故反应后所得溶液中含NH4HSO3为0.21mol-0.11mol=0.1mol,则据电荷守恒得,所得溶液中含SO42-的物质的量为:
=0.11mol,故反应后所得溶液中含NH4HSO3为0.21mol-0.11mol=0.1mol,则据电荷守恒得,所得溶液中含SO42-的物质的量为: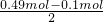 =0.195mol,原固体中含(NH4)2SO4的0.02 mol×
=0.195mol,原固体中含(NH4)2SO4的0.02 mol×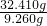 =0.07 mol,所以H2SO4的物质的量为0.195 mol-0.07 mol=0.125 mol,故c(H2SO4)=
=0.07 mol,所以H2SO4的物质的量为0.195 mol-0.07 mol=0.125 mol,故c(H2SO4)=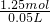 =2.5 mol?L-1,
=2.5 mol?L-1,故答案为:(NH4)2SO4、NH4HSO3;2.5 mol?L-1.
分析:(1)根据表中的数据,计算SO2体积与固体的质量之比的比值,进行判断SO2体积与固体的质量之比相同的组别;
由数据可知第①组实验中固体完全反应,利用SO2体积与固体的质量之比计算.由③④可知,增大固体的质量,产生二氧化硫的体积减小,说明④中盐过量,有一部分没有转化为二氧化硫,故盐中含有(NH4)2SO3;
(2)与足量的熟石灰共热,收集到标准状况的氨气的体积为3136mL,9.260g固体中含有n(NH4+)=
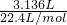 =0.14mol.第①组实验中生成的二氧化硫的体积为
=0.14mol.第①组实验中生成的二氧化硫的体积为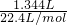 =0.06mol,第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3,故第④组中固体含S(生成二氧化硫)为
=0.06mol,第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3,故第④组中固体含S(生成二氧化硫)为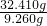 ×0.06mol=0.21mol,含有的NH4+为
×0.06mol=0.21mol,含有的NH4+为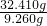 ×0.14mol=0.49mol,由于n(NH4+):n[S(生成二氧化硫)]:=0.49mol:0.21mol>2:1,故固体一定含有(NH4)2SO4,若为(NH4)2SO3、(NH4)2SO4混合,则n[(NH4)2SO3]=0.21mol,所以n[(NH4)2SO4]=
×0.14mol=0.49mol,由于n(NH4+):n[S(生成二氧化硫)]:=0.49mol:0.21mol>2:1,故固体一定含有(NH4)2SO4,若为(NH4)2SO3、(NH4)2SO4混合,则n[(NH4)2SO3]=0.21mol,所以n[(NH4)2SO4]=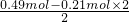 =0.035mol,二者质量之和为0.21mol×116g/mol+0.035mol×132g/mol=28.98g<32.410g,故固体中还含有NH4HSO3;
=0.035mol,二者质量之和为0.21mol×116g/mol+0.035mol×132g/mol=28.98g<32.410g,故固体中还含有NH4HSO3;第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3,根据生成n(SO2)计算溶液中n(NH4HSO3),利用电荷守恒计算溶液中n[(NH4)2SO4],根据第①组实验中数据计算各组分的物质的量,利用质量关系计算第④组实验固体所含有n(SO42-),溶液中n(SO42-)减去固体含有的n(SO42-)为硫酸提供的硫酸根的物质的量,据此计算.
点评:本题考查化学计算、物质组成的测定等,属于计算型推断题,难度很大,判断固体的组成是解题的关键,计算量大,充分利用数据计算确定组成,需要学生具有扎实的基础知识、良好的心理素质与综合运用知识分析解决问题的能力.

实验组别 | ① | ② | ③ | ④ |
硫酸溶液的体积/Ml | 50 | 50 | 50 | 50 |
盐的质量/g | 9.260 | 13.890 | 20.835 | 32.410 |
二氧化硫的体积/mL | 1 344 | 2 016 | 3 024 | 2 464 |
(1)上述四组实验中,SO2体积与固体的质量之比相同的组别有_______________;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945 g该固体进行同样的实验时,产生SO2__________________mL(标准状况);根据表中__________________两组数据变化可确认该固体中一定含有(NH4)2SO3。
(2)另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有__________________ (填化学式),该实验中使用的硫酸的物质的量浓度为__________________。
(15分)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。
(15分)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
|
实验组别 |
① |
② |
③ |
④ |
|
硫酸溶液的体积(mL) |
50 |
50 |
50 |
50 |
|
盐的质量(g) |
9.260 |
13.890 |
20.835 |
32.410 |
|
二氧化硫的体积(mL) |
1344 |
2016 |
3024 |
2464 |
⑴上述四组实验中,SO2体积与固体的质量之比相同的组别有__________________;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945 g该固体进行同样的实验时,产生SO2_________mL(标准状况);根据表中 两组数据变化可确认该固体中一定含有(NH4)2SO3。
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。