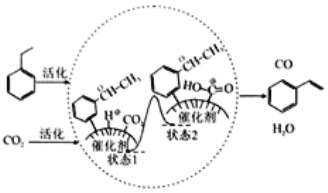
题目内容
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析不正确的是

A.b点溶液中OH-浓度在整个过程中最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.a点溶液显碱性,且离子浓度从大到小为:Na+>CO32->OH->HCO3-
【答案】A
【解析】
溶液中存在碳酸根的水解平衡CO32-+H2OHCO3-+OH-和水的电离平衡H2OH++OH-,图中显示温度升高溶液的碱性先增强后减弱,水的电离是吸热过程,纯水中温度升高pH值会降低,碳酸钠溶液中温度升高pH有增大的过程,说明水解受到促进,即水解为吸热过程;后pH值下降,说明温度升高水电离出更多的氢氧根抑制了碳酸根的水解,据此分析解答。
A. 温度升高,碳酸钠溶液中CO32-的水解程度增大,溶液中的OH-浓度会变大,则b点溶液中OH-浓度在整个过程中不是最大,故A错误;
B. 随温度升高,此时促进盐类水解,对水的电离也起到促进作用,水电离出的氢氧根离子浓度抑制了碳酸盐的水解平衡,导致溶液pH值减小,因此水的电离平衡也对pH产生影响,故B正确;
C. 水解是吸热过程,温度越高,水解程度越大,故a→b段水解平衡向右移动,故C正确;
D. 整个过程中溶液均呈碱性,故a点溶液显碱性,溶液中存在![]() 、
、![]() 、
、![]() ,且电离和水解程度较小,则离子浓度从大到小为:Na+>CO32->OH->HCO3-,故D正确;
,且电离和水解程度较小,则离子浓度从大到小为:Na+>CO32->OH->HCO3-,故D正确;
故选A。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目