题目内容
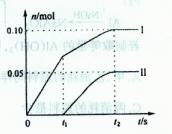
高氯酸是很强的酸,沸点是130℃。质量分数为60%的溶液加热不分解,浓度增高就不稳定,受热易分解,热、浓的高氯酸溶液遇有机物爆炸。为使市售的70%高氯酸进一步浓缩,所采取的措施正确的是
| A.各仪器连接处必须用磨口玻璃 | B.各仪器连接处的橡胶塞应塞紧防止漏气 |
| C.加入生石灰后减压蒸馏 | D.加入浓硫酸后常压蒸馏 |
A
略

练习册系列答案
相关题目
 试液.
试液.
 HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4 地控制次氯酸的浓度,请结合平衡常数解释原因: 。
地控制次氯酸的浓度,请结合平衡常数解释原因: 。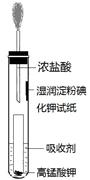
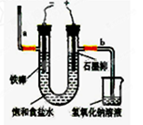

 ,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。 2,为避免此副反应的发生,可采取的措施是 。
2,为避免此副反应的发生,可采取的措施是 。 氯水中只含氯分子
氯水中只含氯分子 天后,几乎无漂白性
天后,几乎无漂白性 5C1—+ ClO3+3H2O。该兴趣小组设计了下列实验装置,进行实验。
5C1—+ ClO3+3H2O。该兴趣小组设计了下列实验装置,进行实验。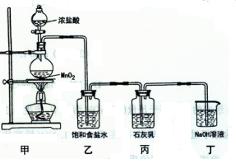
 的化学方程式是 , 乙装置的作用是 。
的化学方程式是 , 乙装置的作用是 。