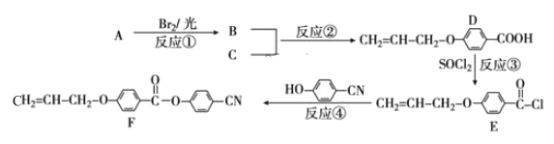
题目内容
【题目】25℃时,在 20 mL 0.1 molL-1 一元弱酸HA溶液中滴加0. 1mol L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与 pH 关系如图所示。下列说法正确的是
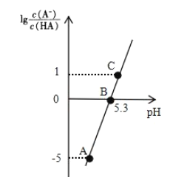
A.A点对应溶液中:c(OH-)>c(H+)
B.25℃时,HA电离常数的数量级为10-5
C.B点对应的 NaOH 溶液体积小于 10 mL
D.对C点溶液加热(不考虑挥发),则![]() 增大
增大
【答案】C
【解析】
A.据图可知A点对应溶液pH<7,所以此时溶液显酸性,c(OH-)<c(H+),故A错误;
B.B点lg![]() =0,即
=0,即![]() =1,此时pH=5.3,即c(H+)=10-5.3mol/L,此时HA电离常数Ka=
=1,此时pH=5.3,即c(H+)=10-5.3mol/L,此时HA电离常数Ka=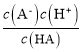 =c(H+)=10-5.3=5.01×10-6,数量级为10-6,故B错误;
=c(H+)=10-5.3=5.01×10-6,数量级为10-6,故B错误;
C.当NaOH的体积为10mL时,溶液中的溶质为等物质的量的HA和NaA,HA电离常数Ka=10-5.3,则Aˉ的水解平衡常数为![]() =10-8.7<10-5.3,所以HA的电离程度比NaA的水解程度要大,即溶液中c(HA)<c(Aˉ),则此时
=10-8.7<10-5.3,所以HA的电离程度比NaA的水解程度要大,即溶液中c(HA)<c(Aˉ),则此时![]() >1,所以若要
>1,所以若要![]() =1,则需要少加入一些NaOH,所以B点对应的NaOH溶液体积小于10 mL,故C正确;
=1,则需要少加入一些NaOH,所以B点对应的NaOH溶液体积小于10 mL,故C正确;
D.![]() 为Aˉ的水解平衡常数的倒数,水解为吸热反应,升高温度,水解平衡常数增大,则其倒数减小,即
为Aˉ的水解平衡常数的倒数,水解为吸热反应,升高温度,水解平衡常数增大,则其倒数减小,即![]() 减小,故D错误;
减小,故D错误;
故答案为C。

练习册系列答案
相关题目