题目内容
【题目】(1)1mol H2SO4中含________个硫原子,__________个氢原子,___________mol氧原子。
(2)2molCO与3molCO2的质量之比________;分子数之比为_______ ;含氧原子的数目之比为______。
(3)用20g NaOH配制成500mL溶液,其物质的量浓度为____________mol/L,从中取出1mL,其物质的量浓度为___________mol/L,含溶质_____________g。若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为___________mol/L。
(4)500mL质量分数为50%的硫酸溶液中 密度为1.568g/cm3,则溶液的物质的量浓度为________mol/L 。
【答案】6.02×1023 或NA1.204×1024 或2 NA414:332:31:3110.040.018
【解析】
(1)1molH2SO4中含硫原子数目为1mol×NAmol-1=NA,含有氧原子物质的量为1mol×4=4mol,含有氢原子的物质的量为2mol,含有H的数目为2NA;
(2)2molCO与3molCO2的质量之比:2mol×28g/mol:3mol×44g/mol=14:33;依据n=![]() ,分子数之比等于物质的量之比,所以2molCO与3molCO2的分子数之比为2:3;含氧原子的数目之比:2mol×1:3mol×2=1:3;
,分子数之比等于物质的量之比,所以2molCO与3molCO2的分子数之比为2:3;含氧原子的数目之比:2mol×1:3mol×2=1:3;
(3)n(NaOH)=![]() =0.5mol,c(NaOH)=
=0.5mol,c(NaOH)=![]() =1mol/L,溶液为均一稳定的混合物,从中取出1mL,其物质的量浓度不变,仍为1mol/L,m(NaOH)=1mol/L×0.001L×40g/mol=0.04g,取出1mL上述溶液,n(NaOH)=1mol/L×0.001L=0.001mol,加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度是
=1mol/L,溶液为均一稳定的混合物,从中取出1mL,其物质的量浓度不变,仍为1mol/L,m(NaOH)=1mol/L×0.001L×40g/mol=0.04g,取出1mL上述溶液,n(NaOH)=1mol/L×0.001L=0.001mol,加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度是![]() =0.01mol/L;
=0.01mol/L;
(4)根据公式c=![]() 可知,质量分数为50%,密度为1.568g/cm3的浓硫酸的浓度为:c=
可知,质量分数为50%,密度为1.568g/cm3的浓硫酸的浓度为:c=![]() mol/L=8.0mol/L。
mol/L=8.0mol/L。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)
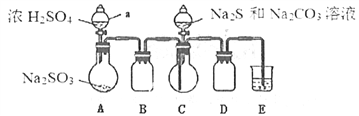
实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
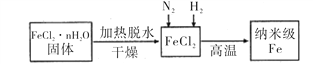
(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
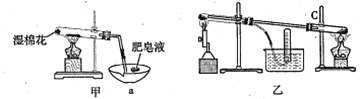
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。