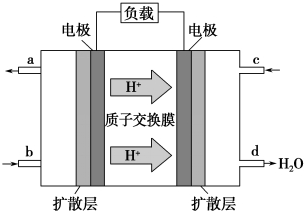
题目内容
17.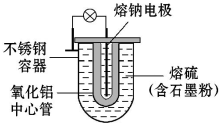 某汽车公司首次发表了Na-S电池的有关报道.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
某汽车公司首次发表了Na-S电池的有关报道.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 充电时熔钠电极与电源的负极相连 | |
| B. | 放电时Na+向正极移动 | |
| C. | 放电时熔钠电极作电池的正极 | |
| D. | 充电时阳极反应式为8Sn2--16e-═nS8 |
分析 A、充电时,原电池的负极和电源的负极相连,原电池的正极和电源的正极相连;
B、原电池中电解质中的阳离子移向正极;
C、放电时,失电子发生氧化反应的金属电极是负极;
D、充电时阳极发生失电子的氧化反应,和放电时的正极反应相反.
解答 解:A、充电时,原电池的负极和电源的负极相连,原电池的正极和电源的正极相连,放电时熔钠电极是负极,充电时熔钠电极与电源的负极相连,故A正确;
B、原电池中电解质中的阳离子移向正极,即Na+向正极移动,故B正确;
C、放电时,熔钠电极失电子发生氧化反应,所以放电时熔钠电极作电池的负极,故C错误;
D、充电时阳极发生失电子的氧化反应,电极反应式为:8Sn2--16e-═nS8,故D正确.
故选C.
点评 本题考查原电池原理,明确电池反应中元素的化合价变化及原电池的工作原理即可解答,注意与氧化还原反应的结合,题目难度不大.

练习册系列答案
相关题目
7.以下说法不正确的是( )
| A. | 物质所含元素化合价升高的反应叫氧化反应 | |
| B. | 在氧化还原反应中,失去电子的元素化合价升高 | |
| C. | 元素从化合态(化合物形式)变为游离态(单质形式),一定是被还原 | |
| D. | 失电子越多的物质,其还原性越强 |
8.T℃时,在3L的密闭容器中充入4mol光气(COCl2),发生反应COCl2(g)?CO(g)+Cl2(g),同时还发生反应2CO(g)?2C(s)+O2(g),当反应达到平衡时,测得CO(g)和C(s)的物质的量分别为2mol和1mol,则该温度下,CO(g)+Cl2(g)?COCl2(g)的平衡常数K为( )
| A. | $\frac{1}{9}$ | B. | 2 | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
12.设NA为阿伏伽德常数的值,下列说法正确的是( )
| A. | 24g镁的最外层电子数为NA | |
| B. | 常温常压下,18g H2O含有的原子总数为3 NA | |
| C. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5 NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1 NA |
9.下列离子方程式正确的是( )
| A. | 氢氧化镁与稀硫酸反应 H++OH-=H2O | |
| B. | 碳酸氢钠溶液与少量石灰水反应HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| D. | 向NaHSO4溶液逐滴滴加Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
6.下列说法中正确的是( )
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
7.下列说法正确的是( )
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 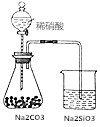 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
 现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).
现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).