题目内容
2.已知1g碳完全燃烧时放出32.79kJ热量,则碳的燃烧热是( )| A. | 32.79 kJ | B. | 32.79 kJ•mol-1 | C. | 393.5 kJ•mol-1 | D. | 393.5 kJ |
分析 燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量,根据热化学方程式的意义结合热化学方程式的书写方法来书写即可.
解答 解:1gC完全燃烧时放出32.79KJ热量,则12g碳即1mol碳完全燃烧时放出32.79KJ×12=393.5kJ的热量,所以C的燃烧热是393.5KJ/mol.
故选C.
点评 本题考查热化学方程式,题目难度不大,注意表示燃烧热的热化学方程式,可燃物为1mol,一般H→H2O(l),C→CO2,S→SO2.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 44gCO2的体积约为22.4L | |
| C. | 将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L | |
| D. | 常温常压下,14g氮气含有的原子数为NA |
10.下列物质中,不含氯气分子的是( )
| A. | 氯气 | B. | 盐酸 | C. | 液氯 | D. | 氯水 |
17.下列物质的水溶液,升高温度时pH值变小的是( )
| A. | 氯化铁 | B. | 硫化钠 | C. | 盐酸 | D. | 碳酸钠 |
7.在0.01mol/L醋酸中加入少量较浓的硫酸后,其变化结果可能是( )
| A. | 氢氧根离子浓度变小 | B. | 醋酸的浓度减小 | ||
| C. | 酸性增强,PH变小 | D. | 醋酸根离子浓度变小 |
11.下列各环境中的离子组合能够大量共存的是( )
| A. | PH=0的溶液:Al3+、NH4+、Ca2+、SO42- | |
| B. | 无色溶液:Mg2+、SO42-、Fe3+、Cl- | |
| C. | 加水稀释后溶液中$\frac{(O{H}^{-})}{c({H}^{+})}$明显减小的溶液:Na+、AlO2-、S2-、SO32- | |
| D. | 加入铝粉产生H2的溶液中,Fe2+、K+、NO3-、Cl- |
12.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系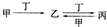 ,下列有关物质的推断正确的是( )
,下列有关物质的推断正确的是( )
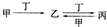 ,下列有关物质的推断正确的是( )
,下列有关物质的推断正确的是( )| A. | 若甲为Al,则丁可能是NaOH溶液 | B. | 若甲为氮气,则丁可能是O2 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为Ca(OH)2溶液,则丁可能是CO2 |