题目内容
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
【答案】 羟基 羧基 ![]() 取代反应
取代反应 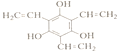
![]()

【解析】 (1) 根据有机物E的结构简式,可知分子中含氧官能团为羟基和羧基,故答案为:羟基、羧基;
(2 ) 根据反应流程图,对比A、X、C的结构和X的分子式为C14Hl5ON可知,X的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3 ) 对比B、C的结构可知,B中支链对位的H原子被取代生成C,属于取代反应,故答案为:取代反应;
(4 ) F为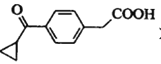 。①能与FeCl3溶液发生显色反应,说明苯环上含有羟基;②能使溴水褪色,说明含有碳碳双键等不饱和键;③有3种不同化学环境的氢,满足条件的F的一种同分异构体为
。①能与FeCl3溶液发生显色反应,说明苯环上含有羟基;②能使溴水褪色,说明含有碳碳双键等不饱和键;③有3种不同化学环境的氢,满足条件的F的一种同分异构体为 ,故答案为:
,故答案为: ;
;
(5)以![]() 为原料制备
为原料制备 ,需要引入2个甲基,可以根据信息
,需要引入2个甲基,可以根据信息![]() 引入,因此首先由苯甲醇制备卤代烃,再生成
引入,因此首先由苯甲醇制备卤代烃,再生成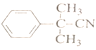 ,最后再水解即可,流程图为
,最后再水解即可,流程图为![]()
 ,故答案为:
,故答案为:![]()
 。
。

 阅读快车系列答案
阅读快车系列答案【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键 | H—H | Cl-Cl | H—Cl |
键能 | 436 | 243 | 431 |
请根据以上信息写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式_______。
(2)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
①以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________________________。
②将质量相等的铁棒和石墨棒分别插入CuCl2溶液中,铁棒接甲烷燃料电池负极,石墨棒接该电池正极,一段时间后测得铁棒比石墨棒增加了6.4克。写出铁棒电极上发生的电极反应式________; 则理论上消耗CH4的体积在标准状况下为_____。
(3)如图所示的实验装置中,丙为用碘化钾溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹;丁为直流电源,x、y为电源的两极;G为电流计;A、B、C、D四个电极均为石墨电极。若在两试管中充满H2SO4溶液后倒立于H2SO4溶液的水槽中,闭合K2,断开K1。

①丙电解时反应的离子方程式为______________。
②继续电解一段时间后,甲池中A、B极均部分被气体包围,此时断开K2,闭合K1,电流计G指针发生偏转,则B极的电极反应式为__________________,C极的电极反应为__________________。
