题目内容
硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺。
3FeS2 + 12C+ 8O2  Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S
A是 (写化学式)。若得到192克的硫磺,则产生标准状况下的A气体 L。
(2)硫的氯化物常做橡胶工业的硫化剂。硫与氯气在一定条件下反应,得到两种硫的氯化物B和D。B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32。计算确定这两种氯化物的分子式分别为 。
(3)硫化氢有毒。在120℃、101kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数。写出推导过程。(不考虑硫化氢的分解)
(4)硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得。取15.12g Na2SO3溶于80.0mL水中,加入5.00g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0mL,再冷却到10℃,则理论上析出Na2S2O3∙5H2O多少克?写出推导过程。(已知:Na2S2O3的溶解度,10℃时为60.0g/100g水,100℃时为207g/100g水。100℃时,Na2S2O3饱和溶液的密度为1.14g/mL)。
(1)CO 268.8 (各1分)
(2)SCl2、S2Cl2 (各2分)
(3)0.7或0.3
(4)23.4
【解析】
试题分析:(1)根据原子守恒可知,A应该是CO,且n=12。192克的硫磺的物质的量=192g÷32g/mol=6mol,所以根据方程式可知,生成的CO是6mol×2=12mol,则CO在标准状况下的体积是12mol×22.4L/mol=268.8L。
(2)B物质中的含硫量为0.3107,则B分子中S和Cl的原子个数之比=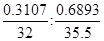 =1:2。D物质中的含氯量为0.5259,则D分子中S和Cl的原子个数之比=
=1:2。D物质中的含氯量为0.5259,则D分子中S和Cl的原子个数之比= =1:1。又因为B的相对分子质量比D小32,所以B和D的化学式分别是SCl2、S2Cl2。
=1:1。又因为B的相对分子质量比D小32,所以B和D的化学式分别是SCl2、S2Cl2。
(3) H2S燃烧的有关方程式是2H2S+
O2  2S+
2H2O(1) 2H2S+
3O2
2S+
2H2O(1) 2H2S+
3O2  2SO2+
2H2O(2)
2SO2+
2H2O(2)
由反应知,当H2S:O2>2:1时,按(1)进行,气体体积可能减少30%;
当2:1>H2S:O2>2:3时既有反应(1)又有反应(2)
设原混合气体中H2S、O2分别为x、yL,气体体积可能减少30%
Ⅰ
2H2S+ O2 2S+ 2H2O 气体体积减少
2S+ 2H2O 气体体积减少
2 1 2 1
2y y 2y y
所以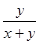 =0.3
=0.3
解得 =
=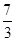
因此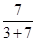 =0.7
=0.7
Ⅱ
xH2S+ yO2 (y-x/2)SO2+(1.5x-y)S+ xH2O
气体体积减少
(y-x/2)SO2+(1.5x-y)S+ xH2O
气体体积减少
x y (y-x/2) x x/2
所以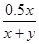 =0.3
=0.3
解得 =
=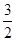
所以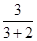 =0.6
=0.6
(4)n(Na2SO3)=15.12g÷126g/mol=0.12mol、n(S)=5.00g÷32g/mol=0.16mol (S过量)
根据100℃的溶解度计算可知,微沸时生成的硫代硫酸钠全部溶解。设析出Na2S2O3∙5H2Oxg
所以根据原子守恒可知,滤液中Na2S2O3有0.12mol,其质量是18.96g。10℃30.0ml溶液中水=30×1.14-18.96=15.24g,所以有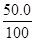 =
=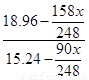 ,解得x=23.4。
,解得x=23.4。
考点:考查气体摩尔体积、物质化学式确定以及根据方程式进行的有关计算

 Fe3O4+nA↑+6S
Fe3O4+nA↑+6S