题目内容
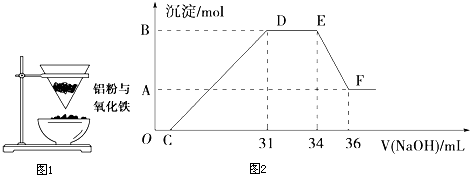
如图1是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”.
(1)写出该反应的化学方程式:
(2)为检验铝热反应后的固体成分,请填写下表:
(3)探究铝热反应后固体的性质:
将反应后容器中的固体残余物置于烧杯中,加入一定量的稀硝酸,固体完全溶解,反应过程中无气体放出(活泼金属可把稀HNO3还原为NH4NO3).在反应后的溶液中缓慢滴加4mol?L-1的NaOH溶液,产生沉淀的物质的量(mol)与加入NaOH溶液的体积(mL)的关系如图2所示:
①写出DE段发生反应的离子方程式:
②B与A的差值为

(1)写出该反应的化学方程式:
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
(2)为检验铝热反应后的固体成分,请填写下表:
| 检验成分 | 操作步骤 | 实验现象与结论 |
| 铝 | 取少量固体样品加入NaOH溶液中 取少量固体样品加入NaOH溶液中 |
若有(无)气泡产生,说明该样品中含有(不含)铝 若有(无)气泡产生,说明该样品中含有(不含)铝 |
| 氧化铁 | 取少量样品加入稀硫酸中,滴加KSCN溶液 取少量样品加入稀硫酸中,滴加KSCN溶液 |
若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3 若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3 |
将反应后容器中的固体残余物置于烧杯中,加入一定量的稀硝酸,固体完全溶解,反应过程中无气体放出(活泼金属可把稀HNO3还原为NH4NO3).在反应后的溶液中缓慢滴加4mol?L-1的NaOH溶液,产生沉淀的物质的量(mol)与加入NaOH溶液的体积(mL)的关系如图2所示:
①写出DE段发生反应的离子方程式:
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
.②B与A的差值为
0.008
0.008
.分析:(1)铝粉和氧化铁在高温下反应生成氧化铝和铁;
(2)根据铝和与氢氧化钠反应以及氧化铁与酸反应生成铁离子,利用KSCN检验;
(3)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,以此解答.
(2)根据铝和与氢氧化钠反应以及氧化铁与酸反应生成铁离子,利用KSCN检验;
(3)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,以此解答.
解答:解:(1)铝粉和氧化铁在高温下反应生成氧化铝和铁,反应的离子方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(2)铝和与氢氧化钠反应,可取少量固体样品加入NaOH溶液中,若有气泡产生,说明该样品中含有铝,否则没有铝;
检验氧化铁,可取少量样品加入稀硫酸中,滴加KSCN溶液,若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3,
故答案为:
(3)①OC发生H++OH-═H2O;CD反应生成氢氧化铝和氢氧化铁沉淀,D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,离子方程式为,NH4++OH-═NH3?H2O,
故答案为:NH4++OH-═NH3?H2O;
②E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH=NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol.
所以B与A差值为0.008mol,
故答案为:0.008.
| ||
| ||
(2)铝和与氢氧化钠反应,可取少量固体样品加入NaOH溶液中,若有气泡产生,说明该样品中含有铝,否则没有铝;
检验氧化铁,可取少量样品加入稀硫酸中,滴加KSCN溶液,若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3,
故答案为:
| 检验成分 | 操作步骤 | 实验现象与结论 |
| 铝 | 取少量固体样品加入NaOH溶液中 | 若有(无)气泡产生,说明该样品中含有(不含)铝 |
| 氧化铁 | 取少量样品加入稀硫酸中,滴加KSCN溶液 | 若溶液变红色,说明原样品中含有Fe2O3,反之,则不含Fe2O3 |
故答案为:NH4++OH-═NH3?H2O;
②E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH=NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol.
所以B与A差值为0.008mol,
故答案为:0.008.
点评:本题综合考查铝的性质,侧重于学生的分析能力和计算能力的考查,注意把握铝的化合物的性质,结合反应的图象进行计算,解题时注意两点:1.有两种金属,铝和铁,其中氢氧化铝具有两性,2.HNO3的还原产物有N2O,NO,NO2,NH4+等,其中,铵根可以保留在溶液中,且可以与氢氧化钠反应.

练习册系列答案
相关题目