��Ŀ����
����һ����Ҫ�Ļ���ԭ�ϣ�ijѧϰС������ȡ������̽�������ʣ�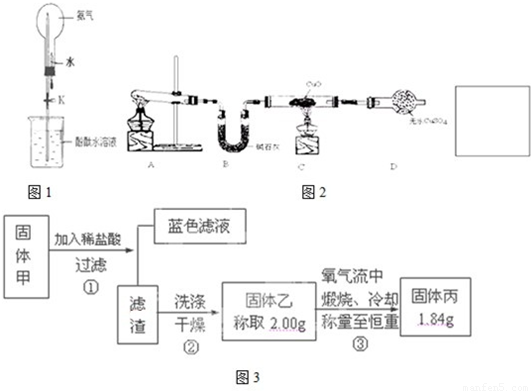
��ش�
��1��ʵ������ȡ�����Ļ�ѧ����ʽ�� ��
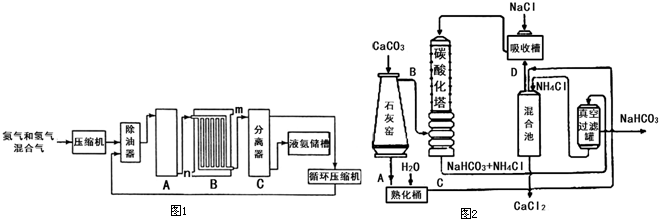
��2������ͼ1�ǽ��а�����Ȫʵ���װ�ã�������Ȫ�IJ��������� ��
�ڰ���ʹ�ձ�����Һ����ɫ��Ϊ��ɫ����ԭ���ǣ��õ��뷽��ʽ ��ʾ�� ��
��3����С��ͬѧ�����ͼ2��ʾ��ʵ��װ�ã����ּг�����δ��������̽�������Ļ�ԭ�Բ�������
��ʵ������Ϊ����ɫCuO��Ϊ��ɫ����ɫ��ˮCuSO4��ĩ��Ϊ��ɫ��ͬʱ����һ����ɫ���壬����������Ⱦ����д��������CuO��Ӧ�Ļ�ѧ����ʽ ��
�ڼ�ʯ�ҵ������� ��
������װ���ڷ���Ӧ����һ��װ�ú�ʵ����ƲŽ����ƣ����ڷ����в�����Eװ��ͼ��Ҫ�� ע��װ���������Լ����ƣ� ��
��.3.2g Cu��30mL��8mol/L����HNO3��Ӧ������Ļ�ԭ����ΪNO��NO2����Ӧ����Һ������H+Ϊa mol���ٴ�ʱ��Һ��������NO3-Ϊ mol��
�������ɵ�NO�ڱ�״�������Ϊ L�������Ͻ�����ú�a�Ĵ���ʽ��ʾ��
��ij��ɫ������ܺ�������ͭ����ͭ������ͭ���Լ����ڱε�������ͭ��
��������֪����
��������ͭ�����Ի����»ᷢ������������ԭ��Ӧ����Cu2+��ͭ���ʣ��������������գ�����ת��Ϊ����ͭ��
����ͭ������ͭ�����¶�������ϡ���ᣮ�������������գ���ͭ������ͭ��ת��Ϊ����ͭ�Ͷ�������Ϊ���о��ijɷ֣���С��ͬѧ���ռ����㹻���Ĺ����������ͼ3��ʾ��ʵ�飺
��1�����������չ�����һ�������ķ�Ӧ�Ļ�ѧ����ʽΪ ��
��2�����ڹ���ijɷֵ��ж��У�����˵����ȷ����
A��������У�CuS��Cu2S����ͬʱ���ڣ�
B��������У�CuO��Cu2O������һ�֣�
C�����������û��Cu2O����һ����Cu2S��
D���������������Cu2O��Ҳ������Cu2S��
���𰸡���������1��ʵ�������Ȼ�狀��������Ƽ�����ȡ������
��2���ٰ����Ǽ�������ˮ�����壬��������ˮ����ƿ��ѹǿ���٣�����ѹǿ�������Һ������ƿ��
�ڰ���������ˮ����һˮ�ϰ���һˮ�ϰ�����������ʣ���������������ӣ�
��3���ٸ���ʵ�������ж������
�ڼ�ʯ���Ǹ������
�۸��ݰ��������ʷ����жϣ���ֹ��Ⱦ������
��ͭ��������ᷴӦ����Ӧ����Һ�е����������������ͭ������������NO3-��H+������ͭ��NO3-��Cu2+�Ĺ�ϵʽ��⣻
�ڸ��ݵ����غ�͵�Ԫ���غ���⣻
��1���۸������ʵ����ʺ������仯�ĽǶ�֪��Ӧ��
��2���������ϡ����õ�����ɫ��Һ��˵������ijɷ���CuO��Cu2O������һ�֣�
������Ӧ��Cu+O2 CuO ���أ�Cu2S+2O2
CuO ���أ�Cu2S+2O2 2CuO+2SO2 ���䣻2CuS+3O2
2CuO+2SO2 ���䣻2CuS+3O2 2CuO+2SO2 ���أ�������������ҳ�ȡ2.00g�������������ա���ȴ���������أ��ù����1.84g������ʵ�ʱ����ˣ�˵������CuS�������������ʣ�
2CuO+2SO2 ���أ�������������ҳ�ȡ2.00g�������������ա���ȴ���������أ��ù����1.84g������ʵ�ʱ����ˣ�˵������CuS�������������ʣ�
����⣺��1���ڼ��������£��Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�������ˮ��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2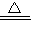 CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��2����NH3�����ܽ���ˮ��1���ˮ�ܽ�700�����������ֹˮ�м�����ͷ�ι��е�ˮ��Ȼ���ֹˮ��K�����ڰ���Ѹ���ܽ��ڼ�����ͷ�ι��е�ˮ��������ƿ������ѹǿѸ�ټ�С��������Һ������ƿ������Ȫ����
�ʴ�Ϊ�����ἷѹ�ιܣ�ʹ����ˮ������ƿ��Ȼ���ֹˮ��K��
�ڰ�����ˮ��Ӧ����һˮ�ϰ���һˮ�ϰ������笠����Ӻ����������ӣ��������뵼����Һ�ʼ��ԣ���̪��Һ������ɫ��
�ʴ�Ϊ��NH3+H2O?NH3?H2O?NH4++OH-��
��3���ٺ�ɫCuO��Ϊ��ɫ����ɫ��ͭ��������������ͭ����ɫ��ˮCuSO4��ĩ��Ϊ��ɫ������ˮ������ͭ��˵�������ﺬ��ˮ��ͬʱ����һ����ɫ���壬����������Ⱦ�����Ը������ǵ�����
�ʴ�Ϊ��3CuO+2NH3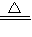 3Cu+N2+3H2O��
3Cu+N2+3H2O��
�ڼ�ʯ���Ǹ������������ˮ��������ֹ���Ų���ˮ�IJⶨ���ʴ�Ϊ�����հ����л��е�ˮ��������ֹ���Ų���ˮ�IJⶨ��
�۰����Ǵ̼������壬���Բ������������Ӧ��β������װ�ã�������������ˮ���ʴ�Ϊ������һ�����հ���װ�ã���ͼ��ʾ��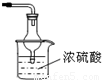 ��
��
��
��3.2gCu�����ʵ�����n��Cu��=3.2g÷64g/mol=0.05mol��
Cu��NO3��2 =Cu2++2NO3-��HNO3�TH++NO3-
0.05mol 0.1mol amol amol
���ʱ��Һ�к���NO3-�����ʵ���Ϊ��0.1+a ��mol��
��Ũ������ͭ��Ӧ����NO2�����ŷ�Ӧ�Ľ��У������Ũ�����ͣ�������NO����Ӧ����Һ�����������n��NO3-��=0.1+amol��30mL��8mol/L����HNO3��Ӧ��n��HNO3��=0.24mol������������NOΪxmol��NO2Ϊymol��
��NԪ���غ��֪��x+y=0.24-��0.1+a�������ݵ����غ�ɵã�3x+y=2×0.05
��֮�ã�x=��0.02-0.5a��mol��
�ʴ�Ϊ����0.02-0.5a��×22.4L��
��
��1���۸��ݷ�Ӧ�жϣ�Cu+O2 CuO ���أ�Cu2S+2O2
CuO ���أ�Cu2S+2O2 2CuO+2SO2 ���䣻2CuS+3O2
2CuO+2SO2 ���䣻2CuS+3O2 2CuO+2SO2 ���أ���һ����2CuS+3O2
2CuO+2SO2 ���أ���һ����2CuS+3O2 2CuO+2SO2���ʴ�Ϊ��2CuS+3O2
2CuO+2SO2���ʴ�Ϊ��2CuS+3O2 2CuO+2SO2��
2CuO+2SO2��
��2���������ϡ����õ�����ɫ��Һ��˵������ijɷ���CuO��Cu2O������һ�֣�
������������ҳ�ȡ2.00g�������������ա���ȴ���������أ��ù����1.84g������ʵ�ʱ����ˣ�˵������CuS����Ҫ���������ʣ����ۣ�������Cu2O��Cu2S���п��ޣ�������Cu2O������Cu2S�������Ϸ��������ڹ���ijɷֵ��ж��У���ȷ����BCD���ʴ�Ϊ��BCD��
���������⿼���˰��������ʺ���ȡ��������������ԭ��Ӧ�ļ��㣬������ͭ��������ʣ��ѶȽϴ��ۺ���ǿ���������������ʵ����Ƶ���Ϣ���˽��ԭ��������������ԭ��Ӧ�ļ��㣬ע��������غ㡢����غ�ĽǶȽ����⣮
��2���ٰ����Ǽ�������ˮ�����壬��������ˮ����ƿ��ѹǿ���٣�����ѹǿ�������Һ������ƿ��
�ڰ���������ˮ����һˮ�ϰ���һˮ�ϰ�����������ʣ���������������ӣ�
��3���ٸ���ʵ�������ж������
�ڼ�ʯ���Ǹ������
�۸��ݰ��������ʷ����жϣ���ֹ��Ⱦ������
��ͭ��������ᷴӦ����Ӧ����Һ�е����������������ͭ������������NO3-��H+������ͭ��NO3-��Cu2+�Ĺ�ϵʽ��⣻
�ڸ��ݵ����غ�͵�Ԫ���غ���⣻
��1���۸������ʵ����ʺ������仯�ĽǶ�֪��Ӧ��
��2���������ϡ����õ�����ɫ��Һ��˵������ijɷ���CuO��Cu2O������һ�֣�
������Ӧ��Cu+O2
 CuO ���أ�Cu2S+2O2
CuO ���أ�Cu2S+2O2 2CuO+2SO2 ���䣻2CuS+3O2
2CuO+2SO2 ���䣻2CuS+3O2 2CuO+2SO2 ���أ�������������ҳ�ȡ2.00g�������������ա���ȴ���������أ��ù����1.84g������ʵ�ʱ����ˣ�˵������CuS�������������ʣ�
2CuO+2SO2 ���أ�������������ҳ�ȡ2.00g�������������ա���ȴ���������أ��ù����1.84g������ʵ�ʱ����ˣ�˵������CuS�������������ʣ�����⣺��1���ڼ��������£��Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�������ˮ��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2
 CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O����2����NH3�����ܽ���ˮ��1���ˮ�ܽ�700�����������ֹˮ�м�����ͷ�ι��е�ˮ��Ȼ���ֹˮ��K�����ڰ���Ѹ���ܽ��ڼ�����ͷ�ι��е�ˮ��������ƿ������ѹǿѸ�ټ�С��������Һ������ƿ������Ȫ����
�ʴ�Ϊ�����ἷѹ�ιܣ�ʹ����ˮ������ƿ��Ȼ���ֹˮ��K��
�ڰ�����ˮ��Ӧ����һˮ�ϰ���һˮ�ϰ������笠����Ӻ����������ӣ��������뵼����Һ�ʼ��ԣ���̪��Һ������ɫ��
�ʴ�Ϊ��NH3+H2O?NH3?H2O?NH4++OH-��
��3���ٺ�ɫCuO��Ϊ��ɫ����ɫ��ͭ��������������ͭ����ɫ��ˮCuSO4��ĩ��Ϊ��ɫ������ˮ������ͭ��˵�������ﺬ��ˮ��ͬʱ����һ����ɫ���壬����������Ⱦ�����Ը������ǵ�����
�ʴ�Ϊ��3CuO+2NH3
 3Cu+N2+3H2O��
3Cu+N2+3H2O�� �ڼ�ʯ���Ǹ������������ˮ��������ֹ���Ų���ˮ�IJⶨ���ʴ�Ϊ�����հ����л��е�ˮ��������ֹ���Ų���ˮ�IJⶨ��
�۰����Ǵ̼������壬���Բ������������Ӧ��β������װ�ã�������������ˮ���ʴ�Ϊ������һ�����հ���װ�ã���ͼ��ʾ��
 ��
����
��3.2gCu�����ʵ�����n��Cu��=3.2g÷64g/mol=0.05mol��
Cu��NO3��2 =Cu2++2NO3-��HNO3�TH++NO3-
0.05mol 0.1mol amol amol
���ʱ��Һ�к���NO3-�����ʵ���Ϊ��0.1+a ��mol��
��Ũ������ͭ��Ӧ����NO2�����ŷ�Ӧ�Ľ��У������Ũ�����ͣ�������NO����Ӧ����Һ�����������n��NO3-��=0.1+amol��30mL��8mol/L����HNO3��Ӧ��n��HNO3��=0.24mol������������NOΪxmol��NO2Ϊymol��
��NԪ���غ��֪��x+y=0.24-��0.1+a�������ݵ����غ�ɵã�3x+y=2×0.05
��֮�ã�x=��0.02-0.5a��mol��
�ʴ�Ϊ����0.02-0.5a��×22.4L��
��
��1���۸��ݷ�Ӧ�жϣ�Cu+O2
 CuO ���أ�Cu2S+2O2
CuO ���أ�Cu2S+2O2 2CuO+2SO2 ���䣻2CuS+3O2
2CuO+2SO2 ���䣻2CuS+3O2 2CuO+2SO2 ���أ���һ����2CuS+3O2
2CuO+2SO2 ���أ���һ����2CuS+3O2 2CuO+2SO2���ʴ�Ϊ��2CuS+3O2
2CuO+2SO2���ʴ�Ϊ��2CuS+3O2 2CuO+2SO2��
2CuO+2SO2����2���������ϡ����õ�����ɫ��Һ��˵������ijɷ���CuO��Cu2O������һ�֣�
������������ҳ�ȡ2.00g�������������ա���ȴ���������أ��ù����1.84g������ʵ�ʱ����ˣ�˵������CuS����Ҫ���������ʣ����ۣ�������Cu2O��Cu2S���п��ޣ�������Cu2O������Cu2S�������Ϸ��������ڹ���ijɷֵ��ж��У���ȷ����BCD���ʴ�Ϊ��BCD��
���������⿼���˰��������ʺ���ȡ��������������ԭ��Ӧ�ļ��㣬������ͭ��������ʣ��ѶȽϴ��ۺ���ǿ���������������ʵ����Ƶ���Ϣ���˽��ԭ��������������ԭ��Ӧ�ļ��㣬ע��������غ㡢����غ�ĽǶȽ����⣮

��ϰ��ϵ�д�
 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
�����Ŀ