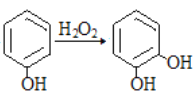
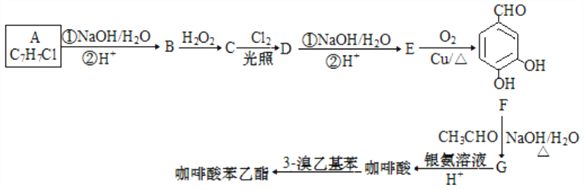
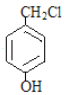
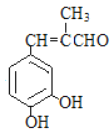
题目内容
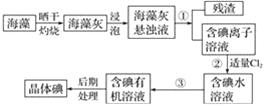
【题目】某同学用某种粗盐进行提纯实验,步骤见下图。

请回答:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法_________________________________。步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止_______________,当蒸发皿中有较多量固体出现时,应___________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入____,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,_______________ | ________ | 猜想Ⅲ成立 |
【答案】过滤滴加盐酸至无气泡放出为止局部过热,造成固体(或溶液)飞溅停止加热(或熄灭酒精灯)有气泡冒出,烧杯内壁变浑浊稀硝酸(或稀盐酸)猜想Ⅱ不成立滴加BaCl2溶液和稀硝酸有白色沉淀生成且不溶于稀硝酸
【解析】
(1)经过①和②的操作分离出了可溶物和不溶物,故操作名称为过滤;
(2)碳酸钠会与盐酸反应产生二氧化碳气体,判断加入盐酸是否适量的方法是:滴加盐酸至无气泡放出为止;热蒸发时要用玻璃棒不断搅拌,这是为了防止受热不均匀造成固体测出;当蒸发皿中有较多量固体出现时,应停止加热,利用余热蒸干;
(3)猜想Ⅰ:碳酸根离子遇到盐酸会产生二氧化碳气体,该气体能使澄清石灰水变浑浊,因此实验现象为有气泡冒出,烧杯内壁变浑浊;
猜想Ⅱ:碳酸钡会溶于硝酸,而硫酸钡不会溶于硝酸,所以验证方法为:滴入稀硝酸,又因为实验现象是有气泡放出,无白色沉淀,所以结论为猜想Ⅱ不成立;
猜想Ⅲ:要检验硫酸根离子需要滴入硝酸酸化的氯化钡,生成不溶于硝酸的白色沉淀,验证方法为:滴入BaCl2溶液和稀HNO3,现象:有白色沉淀且不溶于稀HNO3,结论:猜想Ⅲ成立。

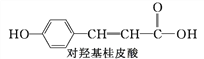
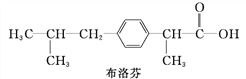
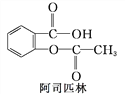
【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。右表是1 L“鲜花保鲜剂”的成分(其中阿司匹林不含K+ ,其存在也不会干扰成分中其他离子的检验),回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是_____________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为________________ mol·L-1。(只要求写表达式,不用化简,不需计算)。
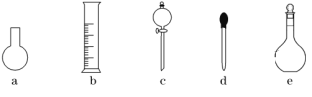
(3)下图所示的仪器中,在配制一定量浓度的“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有_______________(填仪器名称)。
(4)市面上,有一种营养液可用于无土栽培,该营养液中有KCl和K2SO4,其中K+的浓度为0.5mol/L,Cl-的浓度为0.1mol/L,则100mL该营养液中n(SO42-)=_______ mol。
(5)欲检验“鲜花保鲜剂”中的硫酸根离子,步骤是:取少量鲜花保鲜剂于试管中,滴加足量的盐酸后,再滴加___________溶液,看到______________,证明有硫酸根离子。