题目内容
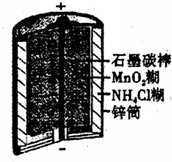 (2011?内江三模)曰常生活中所用的锌-锰干电池结构及成分如右图所示,对使用一段时间后的电池进行分析得其含有NH3、Mn203、ZnCl2、MnO2、NH4Cl、Zn、H2O等7种物质,根据以上信息,判断下列说法正确的是( )
(2011?内江三模)曰常生活中所用的锌-锰干电池结构及成分如右图所示,对使用一段时间后的电池进行分析得其含有NH3、Mn203、ZnCl2、MnO2、NH4Cl、Zn、H2O等7种物质,根据以上信息,判断下列说法正确的是( )分析:A、根据电池的构成情况来确定电解质的成分;
B、原电池中,阳离子移向正极;
C、原电池的正极发生得电子的还原反应;
D、根据电子守恒来计算.
B、原电池中,阳离子移向正极;
C、原电池的正极发生得电子的还原反应;
D、根据电子守恒来计算.
解答:解:A、根据锌-锰干电池的构成情况,确定电解质的成分是ZnCl2、MnO2、NH4Cl等的混合糊状物,故A错误;
B、锌-锰干电池中,阳离子NH4+移向正极,故B错误;
C、原电池的正极石墨电极发生得电子的还原反应,即发生的反应为:2MnO2+2NH4++2e═Mn2O3+2NH3+H2O,故C正确;
D、电解一定浓度的CuSO4溶液,当产生11.2LH2时,根据2H++2e-=H2↑,则铜离子已经得电子完毕,转移电子是大于1mol,根据锌-锰干电池的负极反应Zn-2e-=Zn2+,转移电子1mol时,会溶解0.5mol的Zn,质量为32.5g,所以当产生11.2LH2时,溶解掉的锌的质量大于32.5g,故D错误.
故选C.
B、锌-锰干电池中,阳离子NH4+移向正极,故B错误;
C、原电池的正极石墨电极发生得电子的还原反应,即发生的反应为:2MnO2+2NH4++2e═Mn2O3+2NH3+H2O,故C正确;
D、电解一定浓度的CuSO4溶液,当产生11.2LH2时,根据2H++2e-=H2↑,则铜离子已经得电子完毕,转移电子是大于1mol,根据锌-锰干电池的负极反应Zn-2e-=Zn2+,转移电子1mol时,会溶解0.5mol的Zn,质量为32.5g,所以当产生11.2LH2时,溶解掉的锌的质量大于32.5g,故D错误.
故选C.
点评:本题考查了干电池的工作原理,难度不大,可以根据课本知识来解决.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
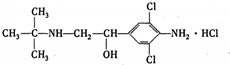 (2011?内江三模)央视一台在2011年“3.15”晚会上,曝光了河南孟州、温县等地一些养猪场,采用违禁动物药品“瘦肉精”喂养生猪.如图是“痩肉精一盐酸克伦特罗”的结构,下列说法正确的是( )
(2011?内江三模)央视一台在2011年“3.15”晚会上,曝光了河南孟州、温县等地一些养猪场,采用违禁动物药品“瘦肉精”喂养生猪.如图是“痩肉精一盐酸克伦特罗”的结构,下列说法正确的是( )