题目内容
(2011?内江三模)下表评价合理的是 ( )
分析:A、从氢氧化镁的溶解度比碳酸镁小分析,反应向更难溶的方向进行;
B、从二氧化硫的漂白性实质分析判断;
C、从有些弱酸阴离子能促进酸式酸根的电离平衡分析判断;
D、从氧化还原反应的顺序反应分析判断;
B、从二氧化硫的漂白性实质分析判断;
C、从有些弱酸阴离子能促进酸式酸根的电离平衡分析判断;
D、从氧化还原反应的顺序反应分析判断;
解答:解:A、氢氧化镁比碳酸镁更难溶,向碳酸氢镁溶液中加入足量的氢氧化钠的离子方程式为
Mg2++2HCO3-+4OH?=Mg(OH)2↓+2H2O+2CO32-,故A错误;
B、二氧化硫的漂白性是二氧化硫生成的亚硫酸结合有机色素形成不稳定的混合物,加热恢复原来的颜色,SO2气体通入溴水,溴水褪色,是发生了氧化还原反应,二氧化硫做还原剂,故正确;
C、HCO3-存在电离平衡,AlO2-和电离出的氢离子和水能生成氢氧化铝沉淀,促进碳酸氢根的电离,不能共存,故C错误;
D、Cl2与含等物质的量FeBr2的溶液反应时,亚铁离子的还原性大于溴离子,通入的氯气把亚铁离子全部氧化后,部分氧化溴离子,即通入的氯气不足,可以存在离子反应2Fe2++2Br-+2Cl2═2Fe3++4C1-+Br2,当氯气足量时,Fe2+与Br_的物质的量之比满足l:2的关系,故D错误;
故选B.
Mg2++2HCO3-+4OH?=Mg(OH)2↓+2H2O+2CO32-,故A错误;
B、二氧化硫的漂白性是二氧化硫生成的亚硫酸结合有机色素形成不稳定的混合物,加热恢复原来的颜色,SO2气体通入溴水,溴水褪色,是发生了氧化还原反应,二氧化硫做还原剂,故正确;
C、HCO3-存在电离平衡,AlO2-和电离出的氢离子和水能生成氢氧化铝沉淀,促进碳酸氢根的电离,不能共存,故C错误;
D、Cl2与含等物质的量FeBr2的溶液反应时,亚铁离子的还原性大于溴离子,通入的氯气把亚铁离子全部氧化后,部分氧化溴离子,即通入的氯气不足,可以存在离子反应2Fe2++2Br-+2Cl2═2Fe3++4C1-+Br2,当氯气足量时,Fe2+与Br_的物质的量之比满足l:2的关系,故D错误;
故选B.
点评:本题考查了反应向更难溶的方向进行,向更难电离的方向进行的判断,二氧化硫的漂白性实质,氧化还原反应的顺序反应规律的应用和离子方程式的书写判断.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
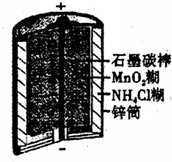 (2011?内江三模)曰常生活中所用的锌-锰干电池结构及成分如右图所示,对使用一段时间后的电池进行分析得其含有NH3、Mn203、ZnCl2、MnO2、NH4Cl、Zn、H2O等7种物质,根据以上信息,判断下列说法正确的是( )
(2011?内江三模)曰常生活中所用的锌-锰干电池结构及成分如右图所示,对使用一段时间后的电池进行分析得其含有NH3、Mn203、ZnCl2、MnO2、NH4Cl、Zn、H2O等7种物质,根据以上信息,判断下列说法正确的是( )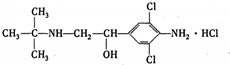 (2011?内江三模)央视一台在2011年“3.15”晚会上,曝光了河南孟州、温县等地一些养猪场,采用违禁动物药品“瘦肉精”喂养生猪.如图是“痩肉精一盐酸克伦特罗”的结构,下列说法正确的是( )
(2011?内江三模)央视一台在2011年“3.15”晚会上,曝光了河南孟州、温县等地一些养猪场,采用违禁动物药品“瘦肉精”喂养生猪.如图是“痩肉精一盐酸克伦特罗”的结构,下列说法正确的是( )