题目内容
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)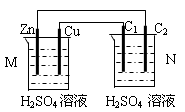
| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
CD
解析试题分析:M装置中Zn、Cu电极的活泼性不同,与硫酸溶液形成原电池,Zn是负极,Cu是正极,N装置为电解池,C1与正极相连,则C1是阳极,阳极上发生氧化反应,故A错误;原电池内电路中,硫酸根是阴离子,阴离子移向负极,则硫酸根离子移向Zn电极,氢离子是阳离子,阳离子移向正极,故B错误;负极反应式为Zn—2e-=Zn2+,正极反应式为2H++2e-=H2↑,电池总反应为Zn+2H+=Zn2++H2↑,氢离子浓度逐渐减小,因此工作一段时间后M装置中溶液pH增大,N中用惰性电极电解硫酸溶液,实质就是电解水,硫酸浓度逐渐增大,酸性增强,溶液pH减小,故C正确;C2与负极相连,则C2是阴极,硫酸溶液中氢离子是阳离子,阳离子移向阴极,阴极上发生氧化反应,即2H++2e-=H2↑,故D正确。
考点:考查原电池和电解原理,涉及反应类型、离子的移动方向、溶液酸碱性变化、电极反应式等。

按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )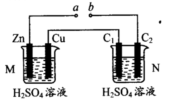
| A.a、b未连接时,装置N中C1电极上有气体析出 |
| B.不论a、b是否连接,装置M中观察到的实验现象相同 |
| C.a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 |
| D.a、b连接,装置M中若有0.1mol SO42-移到Cu电极,装置N中C2极放出 H22.24 L(标准状况) |
下列说法正确的是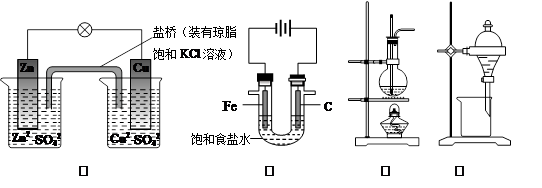
| A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液 |
| B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝 |
| C.图③是用海水制取蒸馏水的装置 |
| D.图④装置可用于乙醇提取碘水中的碘 |
某充电电池的原理如下图所示,溶液中c(H+)="2.0" mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色(V 3+)变为紫色(V2+)。下列对此电池叙述正确的是( )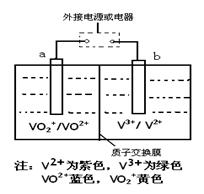
| A.充电时,b极接直流电源正极,a极接直流电源负极 |
| B.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O |
| D.放电时,当转移1.0 mol电子时生成1.0 mol H+,且H+从左槽迁移进右槽 |
Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是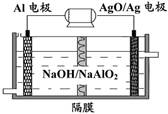
| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |
下图是模拟电化学反应的装置图。下列有关叙述中,错误的是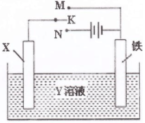
| A.X为碳棒,Y为NaCl溶液,开关K置于N处,溶液中阳离子移向碳棒 |
| B.X为锌棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,该法称为牺牲阳极的阴极保护法 |
| C.X为铜棒,Y为CuSO4溶液,开关K置于M处,铜棒质量将增加,外电路中的电子流向铜棒 |
| D.X为铜棒,Y为CuSO4溶液,开关K置于N处,铁棒质量将增加,溶液中Cu2+浓度不会改变 |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O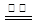 KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
| A.电解时,石墨作阳极,不锈钢作阴极 |
| B.电解时的阳极电极反应式:I-?6e-+3H2O = IO3-+6H+ |
| C.当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D.电解一段时间后,电解质溶液的pH变小 |
碘盐的主要成分是KIO3和NaCl,KIO3在工业上可用电解法制取,以石墨和铁为电极,电解KI溶液,反应方程式为KI+3H2O=KIO3 +3H2↑。下列有关说法中正确的是
| A.电解时,石墨作阴极,铁作阳极 |
| B.电解时,在阴极上产生KIO3 |
| C.电解后电解质溶液pH变大 |
| D.电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体 |
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |