题目内容
10.写出下列反应的离子方程式.(1)用稀硫酸清洗铁锈Fe2O3+6H+=2Fe3++3H2O
(2)小苏打与食醋混合HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
(3)硫酸铜溶液和氢氧化钡溶液混合Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓.
分析 (1)铁锈的主要成分是氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水;
(2)小苏打的成分是碳酸氢钠,食醋的成分是醋酸,碳酸氢钠和醋酸反应生成醋酸钠、二氧化碳和水;
(3)硫酸铜和氢氧化钡反应生成硫酸钡和氢氧化铜沉淀.
解答 解:(1)铁锈的主要成分是氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)小苏打的成分是碳酸氢钠,食醋的成分是醋酸,碳酸氢钠和醋酸反应生成醋酸钠、二氧化碳和水,离子方程式为HCO3-+CH3COOH=CH3COO-+H2O+CO2↑,
故答案为:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑;
(3)硫酸铜和氢氧化钡反应生成硫酸钡和氢氧化铜沉淀,离子方程式为Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓,故答案为:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓.
点评 本题考查离子方程式的书写,为高频考点,明确物质成分及其性质、离子方程式书写规则是解本题关键,注意碳酸氢钠中碳酸氢根离子不能拆为碳酸根离子和氢离子,为易错点.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
20.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | 生石灰、氯水、漂白粉 | B. | 烧碱、液氯、氨水 | ||
| C. | 干冰、钢、空气 | D. | 盐酸、氮气、胆矾 |
1.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol乙烷分子中含有共价键总数为7NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 标准状况下,22.4L苯完全燃烧耗氧分子数为8.5NA | |
| D. | 1 mol丁烷被氯气完全取代时消耗的氯分子数为10NA |
15.化学与生活密切相关,下列说法不正确的是( )
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 食盐可作调味剂,也可作食品防腐剂 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
20.将amol•L-1NaHS溶液与bmol•L-1NaOH溶液的等体积混合(a>0,b>0),混合后所得溶液中微粒的物质的量浓度关系正确的是( )
| A. | a=b时:c(OH-)=c(H+)+c(HS-) | |
| B. | a=2b时:C(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| C. | a=2.5b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) | |
| D. | 若4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S),a=3b |
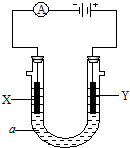 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题: 现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).
现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).