题目内容
【题目】实验室利用下列装置模拟工业生产制备少量硝酸. 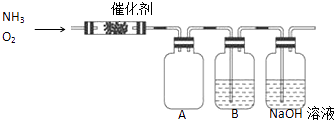
(1)B中试剂为 , NaOH溶液的作用是 .
(2)用过氧化钠与水反应制备氧气的化学方程式为 .
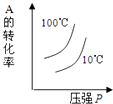
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上.下列图示中,能够正确表示该反应过程能量变化的是 .
A.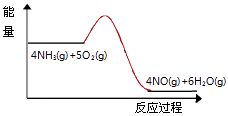
B.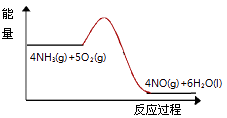
C.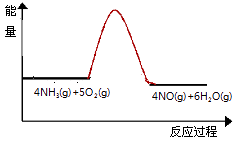
D.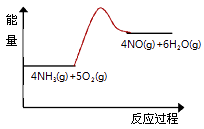
(4)已知2NO2(g)2NO(g)+O2(g)△H
NO2(g) ![]() N(g)+2O(g)
N(g)+2O(g)
NO(g) ![]() N(g)+O(g)
N(g)+O(g)
O2(g) ![]() 2O(g)
2O(g)
①计算反应的△H= .
②请解释高温下,氨气与氧气反应难以生成NO2的原因 .
(5)控制氨气和氧气的比例是制备硝酸的关键.
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟.请用化学方程式表示白烟产生的原因 .
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为 .
【答案】
(1)水;吸收尾气
(2)2Na2O2+2H2O=4NaOH+O2↑
(3)A
(4)+113kJ/mol;2NO2(g)?2NO(g)+O2(g)△H>0,升高温度,平衡正向移动,有利于NO2的分解,因此难以生成NO2
(5)2NO+O2=2NO2 , 3NO2+H2O=2HNO3+NO,NH3+HNO3=NH4NO3;1:2
【解析】解:(1.)装置B中二氧化氮与水反应生成硝酸,用氢氧化钠溶液吸收氮的氧化物,防止污染空气,所以答案是:水;吸收尾气;
(2.)过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑所以答案是:2Na2O2+2H2O=4NaOH+O2↑;
(3.)反应为放热反应,放出大量的热,反应物的总能量比生成物的总能量高,700℃时水是气体,所以答案是:A;
(4.)①△H=反应物的键能和﹣生成物的键能和=931kJ/mol×2﹣628kJ/mol×2﹣493kJ/mol=+113kJ/mol,所以答案是:+113kJ/mol;②二氧化氮分解是吸热反应,升高温度,有利于分解,所以答案是:2NO2(g)2NO(g)+O2(g)△H>0,升高温度,平衡正向移动,有利于NO2的分解,因此难以生成NO2;
(5.)①一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,氨气和硝酸能反应生成硝酸铵,化学方程式:2NO+O2=2NO2 , 3NO2+H2O=2HNO3+NO,NH3+HNO3=NH4NO3所以答案是:2NO+O2=2NO2 , 3NO2+H2O=2HNO3+NO,NH3+HNO3=NH4NO3;②由4NH3+5O2  4NO+6H2O、4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,则原料氨气和氧气物质的量的投料比为1:2,所以答案是:1:2.
4NO+6H2O、4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,则原料氨气和氧气物质的量的投料比为1:2,所以答案是:1:2.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
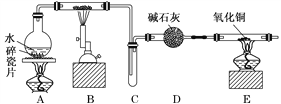
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。