题目内容
4.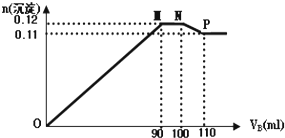 向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图.
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图.(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)BaSO4、Fe(OH)3
(2)从90mL至100 mL之间加入10mL B溶液时发生的离子反应方程式Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓
(3)将A、B溶液中各溶质的物质的量浓度填入下表
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| C(mol/L) |
分析 (1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀完全.
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解.
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共1.1mol.
解答 解:溶液中只有Fe3+被完全沉淀以后,Al3+才开始沉淀.
(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀,
故答案为:BaSO4、Fe(OH)3
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,反应为Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓,故加入的物质:n(NaOH)=n(Na2SO4);
故答案为:Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了(0.12-0.11)mol=0.01mol,消耗了10mLB溶液,Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.01mol
故c(NaOH)=$\frac{0.01mol}{0.01L}$=1mol/L,则共加入Na2SO4为0.01mol,故c(Na2SO4)=$\frac{0.01mol}{0.01L}$=1mol/L,
而整个反应过程共生成BaSO4为0.1L×1mol/L=0.1(mol)故A溶液中c(Ba2+)=$\frac{0.1mol}{0.1L}$=1mol/L.
图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共0.11mol,BaSO4为0.1mol,则Fe(OH)3为(0.11-0.1)mol=0.01mol,A中c(Fe3+)=$\frac{0.01mol}{0.1L}$=0.1mol/L;
第二、三段曲线共消耗B溶液20mL,n(NaOH)=1mol×0.02mol/L=0.02mol,据Al(OH)3+OH-=AlO2-+2H2O,则共溶解的Al(OH)3为0.02mol,则A中c(Al3+)=$\frac{0.02mol}{0.1L}$=0.2mol?L-1,则
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| C(mol/L) | 1 | 1 | 1 | 0.2 | 0.1 |
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| C(mol/L) | 1 | 1 | 1 | 0.2 | 0.1 |
点评 本题考查离子方程式的有关计算,题目难度较大,注意根据图象正确判断各阶段的离子反应,结合各阶段的各种物质的量进行计算.

| A. | N、P、Cl | B. | P、O、C | C. | N、O、S | D. | O、P、Cl |
| A. | 放电时铁做负极,NiO2做正极 | |
| B. | 充电时阴极上的电极反应为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 放电时,电解质溶液中的阴离子是向正极方向移动 | |
| D. | 蓄电池的两个电极必须浸入在碱性溶液中 |
| A. | 1:1:1 | B. | 1:2:3 | C. | 1:4:2 | D. | 3:2:1 |
| A. | N60与N2是同素异形体 | B. | N60一定是比N2更稳定的分子 | ||
| C. | N60的相对分子质量为840 | D. | N60可能是一种很好的火箭燃料 |
| A. | 它的结构与P4相同 | |
| B. | 它的摩尔质量为64 | |
| C. | 它是氧气的同素异形体 | |
| D. | 它是由两个氧分子通过分子间作用力结合而成的新微粒 |
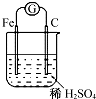
| A. | 铁电极的电极反应式为Fe-3e-═Fe3+ | |
| B. | 溶液中的H+移向Fe电极 | |
| C. | 该装置中能量转化方式为电能转化为化学能 | |
| D. | 电子从铁棒经导线流入石墨棒 |