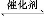题目内容
在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
A.NF3 B.CH3— C.BF3 D.H3O+
C
【解析】由n= 确定中心原子的价层电子对数目,NF3、CH3—、H3O+均为4,则价层电子对空间构型为四面体形,由于形成3个化学键,有1个杂化轨道被孤对电子占据,又由于价层电子对相互排斥,所以分子构型为三角锥形;只有BF3中的n=3,无孤对电子,所以形成平面正三角形分子。
确定中心原子的价层电子对数目,NF3、CH3—、H3O+均为4,则价层电子对空间构型为四面体形,由于形成3个化学键,有1个杂化轨道被孤对电子占据,又由于价层电子对相互排斥,所以分子构型为三角锥形;只有BF3中的n=3,无孤对电子,所以形成平面正三角形分子。

 优学名师名题系列答案
优学名师名题系列答案某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液:
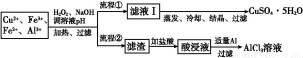
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
请回答下列问题:
(1)加入H2O2的作用是 ,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至 。
(2)写出H2O2与Fe2+反应的离子方程式: 。
(3)流程②中加入适量Al粉起的作用是 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3 (填“能”或“不能”),原因是 。
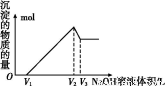
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)= 。
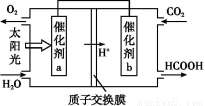
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
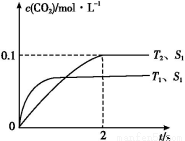
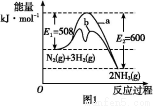
(1)根据图1提供的信息,写出该反应的热化学方程式: ,在图1中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n mol NH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(N2)/n(H2) | p(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ |
|
| 10 |
ⅲ | 480 |
| 10 |
A.请在上表空格中填入剩余的实验条件数据。
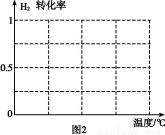
B.根据反应N2(g)+3H2(g) 2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。

已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+  Na2CrO4+ CO2+
Na2CrO4+ CO2+
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 。
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
温度 溶解度 化学式 | 20 ℃ | 60 ℃ | 100 ℃ |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
Na2CrO4 | 84 | 115 | 126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式 。