题目内容
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
(1)2Cu2++4I-=2CuI↓+I2 (2)除去微量的MnO4-,以免影响实验结果的测定
(3)① 2MnO4- ~ 5C2O42- ② 2S2O32- ~ I2 ~ 2Cu2+
2 5 2 2
0.2×8×10-3mol 4×10-3mol 0.25×8×10-3mol 2×10-3mol
n (C2O42-)= 4×10-3mol n (Cu2+)= 2×10-3mol
③电荷守恒 质量守恒 ④K2Cu(C2O4)2·H2O
(3)① 2MnO4- ~ 5C2O42- ② 2S2O32- ~ I2 ~ 2Cu2+
2 5 2 2
0.2×8×10-3mol 4×10-3mol 0.25×8×10-3mol 2×10-3mol
n (C2O42-)= 4×10-3mol n (Cu2+)= 2×10-3mol
③电荷守恒 质量守恒 ④K2Cu(C2O4)2·H2O
试题分析:(1)由Cu2+→
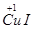 ~e-,2I-→I2~2e-,结合原子守恒和电荷守恒配平。
~e-,2I-→I2~2e-,结合原子守恒和电荷守恒配平。(2)MnO4-与C2O42-发生氧化还原反应,加热可使二者反应充分,防止MnO4-对后面的实验干扰。
(3)①由关系式2MnO4- ~ 5C2O42-,n (C2O42-)=
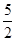 n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;
n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;②由关系式2S2O32- ~ I2 ~ 2Cu2+,n (Cu2+)= n (S2O32-)= 0.25×8×10-3mol = 2×10-3mol
③电荷守恒式:n(K+)+2n(Cu2+)=2n( C2O42-),将n (Cu2+)= 2×10-3mol,n (C2O42-)= 4×10-3mol带入,解得n(K+)=4×10-3mol;m(H2O)=m(样品)-m (K+)- m(Cu2+)-m( C2O42-)。
④m(H2O)="0." 6720g-4×10-3mol×39g?mol-1-2×10-3mol×64g?mol-1-4×10-3mol×88 g?mol-1=0.036g
n(H2O)="0.036" g/(18 g?mol-1)="0." 002 mol,即n(K+): n(Cu2+): n( C2O42-):n(H2O)=2:1:2:1,即化学式为K2Cu(C2O4)2·H2O。

练习册系列答案
相关题目
 mol
mol MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中


 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题: