��Ŀ����
����Ŀ����ͼ��ʾ��װ���У���ͨ��ֱ����5 minʱ��ͭ�缫��������2.16 g��

��1����Դ�缫X������Ϊ________��
��2��pH�仯��A_______��B_______��C_______��(��������������С������������)
��3��ͨ��5 min��B�й��ռ�224 mL����(��״��)����Һ���Ϊ200 mL����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ______________(����ǰ����Һ����ޱ仯)��
��4����A��KCl��Һ�����Ҳ��200 mL��������Һ��pHΪ_______(����ǰ����Һ����ޱ仯)
���𰸡����������С����0.025 mol��L��113
��������
(1)��ͭ�缫���������ӣ�����Ag++e-�TAg����Cu�缫Ϊ������AgΪ������YΪ��������֪XΪ��Դ�ĸ�����
(2)A�е���Ȼ��أ�����KOH������pH����B�е������ͭ��Һ�������ᣬ��Һ��������Ũ������pH��С��C��������ӦΪAg++e-�TAg��������ӦΪAg-e-�TAg+����ҺŨ�Ȳ��䣬��pH���䣻
(3)C��������ӦΪAg++e-�TAg��n(Ag)=![]() =0.02mol����ת�Ƶĵ���Ϊ0.02mol��B��������ӦΪ4OH--4e-�T2H2O+O2������ת��0.02mol������������Ϊ0.005mol�������Ϊ0.005mol��22.4L/mol=0.112L=112mL����������Ҳ����112mL���壬��2H++2e-�TH2���������������ʵ���Ϊ0.005mol���÷�Ӧת�Ƶĵ���Ϊ0.01mol����Cu2++2e-�TCu��ת��0.01mol���ӣ�����Cu2+�����ʵ���Ϊ0.005mol��ͨ��ǰc(CuSO4)=
=0.02mol����ת�Ƶĵ���Ϊ0.02mol��B��������ӦΪ4OH--4e-�T2H2O+O2������ת��0.02mol������������Ϊ0.005mol�������Ϊ0.005mol��22.4L/mol=0.112L=112mL����������Ҳ����112mL���壬��2H++2e-�TH2���������������ʵ���Ϊ0.005mol���÷�Ӧת�Ƶĵ���Ϊ0.01mol����Cu2++2e-�TCu��ת��0.01mol���ӣ�����Cu2+�����ʵ���Ϊ0.005mol��ͨ��ǰc(CuSO4)=![]() =0.025 molL-1��
=0.025 molL-1��
(4)��A�з���2KCl+2H2O![]() 2KOH+H2��+Cl2����2e-���ɵ����غ��֪��ת��0.02mol����ʱ����0.02molKOH��������Һ����ı仯����c(OH-)=
2KOH+H2��+Cl2����2e-���ɵ����غ��֪��ת��0.02mol����ʱ����0.02molKOH��������Һ����ı仯����c(OH-)=![]() =0.1molL-1����ҺpH=13��
=0.1molL-1����ҺpH=13��

����Ŀ��һ�ָ߷��ӻ����VI����Ŀǰ�г������е�ǽ��Ϳ��֮һ����ϳ�·�����£���Ӧ����һ�������½��У���
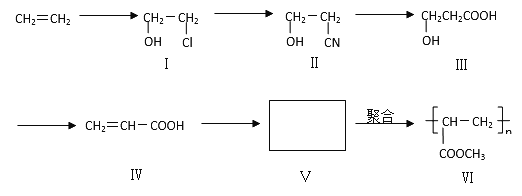
�ش��������⣺
��1��Ŀǰ��ҵ��������ϩ��Ҫ���� Ϊԭ��ͨ�� ��Ӧ��ʵ�֡�
��2��������III���ɻ�����IV������һ�ֲ����� ������ʾ���÷�Ӧ���淴Ӧԭ��������Ϊ100%��
��3��д���ϳ�·���дӻ�����IV��������VI��������Ӧ�Ļ�ѧ����ʽ�� �� ��
��4�����й��ڻ�����III��IV��V��˵���У���ȷ���� ������ĸ��
A��������III���Է���������Ӧ |
B��������III��������NaOH ��Һ��Ӧ |
C��������IV�������������ӳɷ�Ӧ |
D��������III��IV��V����������Ʒ�Ӧ�������� |
E��������IV��V������ʹ������Ȼ�̼��Һ��ɫ
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
![]()
![]()
![]() +H2O
+H2O

�����õ����й��������£�
��Է������� | �ܶ�/��gcm��3�� | �е�/�� | �ܽ��� | |
������ | 100 | 0.961 8 | 161 | ����ˮ |
����ϩ | 82 | 0.810 2 | 83 | ������ˮ |
�ϳɷ�Ӧ��
��a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣮb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森
�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10g��
�ش��������⣺
��1��װ��b��������__________��
��2���������Ƭ��������_________���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������________������ȷ�𰸱�ţ���
A���������� B����ȴ�� C�����貹�� D����������
��3����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ________________________��
��4����Һ©����ʹ��ǰ����ϴ�ɾ���__________���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©����______________����Ͽڵ��������¿ڷų�������
��5�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ����_______________��
��6���ڻ���ϩ�ֲ�����������У��������õ���������______������ȷ�𰸱�ţ���
A��������ƿ B���¶ȼ� C������ƿ D�������� E��������
��7����ʵ�����õ��Ļ���ϩ������________������ȷ�𰸱�ţ���
A��41% B��50% C��61% D��70%
