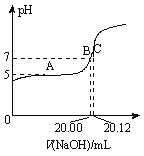
题目内容
【题目】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______;
A .容器中气体总质量不变
B. c(O2)不变
C. υ(O2)=1.25υ(NH3)
D. 体系压强不变
E. 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)已知上述反应达到平衡后,该反应各物质的浓度的定量关系称之为K,其表达式可表示为K =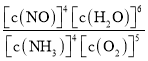 。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______,速率又逐渐减小的原因是_____。
(4)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式_____。
(5)若将(4)所述反应设计为原电池,负极反应式 ______。
【答案】BDE [66a10]/[55(1—a)9V] 体系温度升高 反应物浓度减小 4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-4a kJ·mol—1 2NH3—6e—+6OH—=N2+6H2O或 2NH3—6e— =N2+6H+
【解析】
(1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理量不变,以此解答该题;
(2)根据化学平衡常数及三段式进行求算;
(3)根据该反应为放热反应,反应过程中温度升高,在反应过程中温度升高和反应物浓度减小是影响反应速率的因素;
(4)根据热化学方程式的书写方法可知,物质的物质的量与反应放出的热量成正比,氨气在纯氧中完全燃烧生成无污染的气态物质应为氮气和水;
(5)原电池的负极发生氧化反应,氨气在负极反应生成氮气。
(1)A.反应前后都是气体,气体质量始终不变,容器中气体总质量不变不能说明反应达到平衡状态;
B.c (O2)不变,说明正逆反应速率相等,达到了平衡状态;
C.υ(O2)=1.25υ(NH3),没有说明是正反应速率还是逆反应速率,无法判断是否达到平衡状态;
D.该反应是气体物质的量增大的反应,反应过程中气体的物质的量逐渐增大,压强逐渐增大,若体系压强不变,说明正、逆反应速率相等,达到了平衡状态;
E.相同时间内,消耗0.1mol NH3,同时消耗了0.1mol NO,说明正、逆反应速率相等,反应达到平衡状态;
故答案为:BDE;
(2)根据三段式可知,
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
开始时的物质的量(mol) 4 5 0 0
改变的物质的量(mol) 4a 5a 4a 6a
平衡时的物质的量(mol) 4-4a 5-5a 4a 6a
K=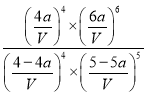 =
=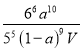 ;
;
(3)由于该反应为放热反应,且反应在绝热密闭系统中进行。所以在反应开始阶段,主要受体系温度升高的影响,反应速率增大;而随着反应的进行,反应物的浓度逐渐降低,所以在反应后阶段,主要受浓度减小因素的影响,反应速率减慢;
(4)氨气在纯氧中完全燃烧生成无污染的气态物质应为氮气和水,1mol氨气燃烧放热akJ,则热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-4a kJ·mol—1;
(5)负极是氨气在反应,在碱性环境中反应的电极反应式为2NH3—6e-+6OH-=N2+6H2O,酸性环境中的电极反应式为2NH3—6e- =N2+6H+。

【题目】法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O
Ⅱ: 2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布式__________
(2)砷烷的空间结构为_________;砷烷中心原子杂化方式为________
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3![]() AsH3
AsH3![]() SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
(4)第一电离能数据I(As)____ I(Se)
(5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。
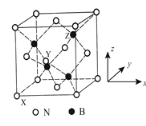
晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)