题目内容
【题目】向含有a mol AlCl3的溶液中加入含b mol KOH的溶液,生成沉淀的物质的量可能是( )
①a mol ②b mol ③![]() mol ④
mol ④![]() mol ⑤0 mol ⑥(4a-b)mol
mol ⑤0 mol ⑥(4a-b)mol
A. ①②④⑤⑥ B. ①④⑤⑥ C. ①②③⑤⑥ D. ①③⑤
【答案】B
【解析】①向含有a mol AlCl3的溶液中加入含b mol KOH的溶液,在化学反应中,参加反应的物质的物质的量之比=化学计量数之比,AlCl3和KOH反应:3KOH+AlCl3=Al(OH)3↓+3KCl,当AlCl3和KOH恰好反应即物质的量之比为1:3时,生成的Al(OH)3物质的量最大为a,②当b≤3a时,反应中KOH不足量,计算时应以KOH为标准进行,设生成Al(OH)3沉淀的物质的量为xmol,根据方程式可知
3KOH+AlCl3=Al(OH)3↓+3KCl
3 1
b x
3:1=b:x
解得x=b/3
③Al(OH)3是两性氢氧化物,能够溶于KOH溶液,当KOH过量时发生反应:KOH+Al(OH)3=KAlO2+2H2O,根据3KOH+AlCl3=Al(OH)3↓+3KCl可得4KOH+AlCl3=KAlO2+3KCl+2H2O,由方程式可得当AlCl3和KOH物质的量之比为1:4时,恰好没有沉淀产生,即沉淀量为0;④根据以上分析可知3a<b<4a时,会出现先有沉淀生成后又有部分沉淀溶解,当全部生成沉淀时,应以AlCl3为标准进行计算,当沉淀生成后又有部分沉淀溶解时,应以剩余的KOH为标准进行计算。设AlCl3全部转化为氢氧化铝时,需要的KOH为ymol,生成氢氧化铝为zmol,根据方程式可知
3KOH+AlCl3=Al(OH)3↓+3KCl
3 1 1
y a z
解得y=3a、z=a
剩余KOH的物质的量为:b-3a,设生成KAlO2时需要氢氧化铝的物质的量为wmol,根据方程式可知
KOH+Al(OH)3=KAlO2+2H2O
1 1
b-3a w
解得w=b-3a,所以剩余氢氧化铝的物质的量为a-(b-3a)=4a-b,综上所述,②③不可能,答案选B。
NaOH的量 | n(NaOH) |
当NaOH不足时 | n(NaOH)=3n[Al(OH)3] |
当NaOH过量时 | n(NaOH)=3n(Al3+)+{n(Al3+)-n[Al(OH)3]}=4n(Al3+)-n[Al(OH)3] |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
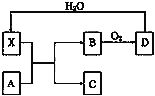
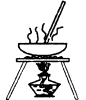
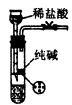
小学生10分钟应用题系列答案【题目】用下列实验装置(夹持装置已略去)进行相应实验,能达到实验目的是( )
A | B | C | D | |
实验 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
装置 |
|
|
|
|
A.A
B.B
C.C
D.D