题目内容
某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
步骤Ⅰ准确称取w g食盐样品于烧杯中,加适量蒸馏水使其完全溶解.
步骤Ⅱ用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全.(已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O)
步骤Ⅲ充分反应后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅳ移取25.00mL样品溶液于250mL锥形瓶中,以淀粉溶液为指示剂,用物质的量浓度为2.0×10-3 mol/L的Na2S2O3标准溶液滴定至终点.(已知:I2+2S2O32-=2I-+S4O62-)
按上述操作方法再重复2次.
(1)根据步骤Ⅳ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入Na2S2O3标准溶液进行滴定,则测得样品中碘含量______(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去Na2S2O3标准溶液的体积_____________(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.(填序号)
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断步骤Ⅳ中反应恰好完全依据的现象是______.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积(mL) | 标准溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 1 | 25.00 | 1.02 | 16.02 |
| 2 | 25.00 | 2.00 | 11.98 |
| 3 | 25.00 | 0.20 | 10.22 |
解:(1)①滴定管用蒸馏水洗涤后要润洗,否则相当于溶液被稀释,则滴定消耗的标准液体积偏大,计算结果待测液浓度的结果偏高,故答案为:偏高;
②锥形瓶用蒸馏水洗涤后,无需润洗,因为有没有谁不影响待测液的物质的量的多少,故答案为:无影响;
③在滴定时,眼睛注视锥形瓶内溶液颜色的变化,故选:B;
④溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(2)标准溶液的体积三次消耗的体积分别为:15.00mL,9.98mL,10.02mL,第一组舍去,2、3组标准溶液的体积的平均值为:10.00mL,
I2 +2S2O32-=2I-+S4O62-
1 2
n(I2) 2.0×10-3 mol/L×0.01L
n=1.0×10-5 mol
所以250mL溶液含有I21.0×10-4mol,
根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~KIO3 ~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-4mol
所以m=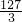 ×10-5g,
×10-5g,
所以设每千克食盐中含碘 ×10-4g=
×10-4g=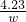 g=
g=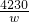 mg/kg,故答案为:
mg/kg,故答案为: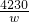 .
.
分析:(1)①滴定管用蒸馏水洗涤后要润洗,否则相当于溶液被稀释;
②锥形瓶用蒸馏水洗涤后,无需润洗;
③根据滴定过程中眼睛应观察锥形瓶内溶液颜色的变化;
④淀粉遇碘变蓝色,达到滴定终点蓝色褪色,
(2)先根据I2+2S2O32-=2I-+S4O62-求出I2的物质的量,然后再根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
点评:本题考查了氧化还原滴定、氧化还原反应的关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量.
②锥形瓶用蒸馏水洗涤后,无需润洗,因为有没有谁不影响待测液的物质的量的多少,故答案为:无影响;
③在滴定时,眼睛注视锥形瓶内溶液颜色的变化,故选:B;
④溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(2)标准溶液的体积三次消耗的体积分别为:15.00mL,9.98mL,10.02mL,第一组舍去,2、3组标准溶液的体积的平均值为:10.00mL,
I2 +2S2O32-=2I-+S4O62-
1 2
n(I2) 2.0×10-3 mol/L×0.01L
n=1.0×10-5 mol
所以250mL溶液含有I21.0×10-4mol,
根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~KIO3 ~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-4mol
所以m=
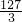 ×10-5g,
×10-5g,所以设每千克食盐中含碘
 ×10-4g=
×10-4g=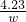 g=
g=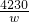 mg/kg,故答案为:
mg/kg,故答案为: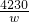 .
.分析:(1)①滴定管用蒸馏水洗涤后要润洗,否则相当于溶液被稀释;
②锥形瓶用蒸馏水洗涤后,无需润洗;
③根据滴定过程中眼睛应观察锥形瓶内溶液颜色的变化;
④淀粉遇碘变蓝色,达到滴定终点蓝色褪色,
(2)先根据I2+2S2O32-=2I-+S4O62-求出I2的物质的量,然后再根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
点评:本题考查了氧化还原滴定、氧化还原反应的关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
北京市场销售的某种食用精制盐包装袋上有如下说明:
碘酸钾与碘化钾在酸性条件下发生如下反应,未能配平化学方程式
KIO3+ KI+ H2SO4═ K2SO4+ I2+ H2O
上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.