题目内容
13.在密闭容器中,反应2X(g)+Y2(g)?2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
| A. | 图I中,甲、乙的平衡常数分别为K1、K2,则K1=K2 | |
| B. | 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 | |
| C. | 图Ⅱ中,t时间是增大了压强 | |
| D. | 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明甲温度高于乙 |
分析 该可逆反应是反应前后气体体积减小的放热反应,
A.图I中,改变条件,平衡向正反应方向移动,改变条件时反应速率与原来平衡点没有接触点,说明改变的条件是增大压强,温度不变,化学平衡常数不变;
B.该反应前后气体体积计量数之和改变,图II中,改变条件平衡不移动,说明加入的是催化剂;
C.根据选项B的分析进行判断;
D.如果改变的条件是温度,根据“先拐先平数值大”知,则乙温度高于甲.
解答 解:反应2X(g)+Y2(g)?2XY(g);△H<0是反应前后气体体积减小的放热反应,
A.图I中,改变条件,平衡向正反应方向移动,改变条件时反应速率与原来平衡点没有接触点,说明改变的条件是增大压强,平衡常数只与温度有关,由于温度不变,则化学平衡常数不变,所以K1=K2,故A正确;
B.该反应前后气体体积计量数之和改变,图II中,改变条件正逆反应速率相等,平衡不移动,说明加入的是催化剂,平衡状态甲、乙的反应物转化率相等,故B错误;
C.根据B知,t时间改变的条件是催化剂,故C错误;
D.该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,则产物含量减少,如果改变的条件是温度,根据“先拐先平数值大”知,则乙温度高于甲,故D错误;
故选A.
点评 本题考查化学反应速率变化的曲线,题目难度中等,注意根据图象中纵横坐标的含义再结合方程式特点分析解答,注意结合“先拐先平数值大”、“定一议二”方法分析图象题,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是( )
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子4 mol | |
| C. | O2一定是氧化产物 | |
| D. | Na2O2不可能发生还原反应 |
5.下列有关化学反应速率的说法中,正确的是( )
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 等质量的锌片分别与同体积、同物质的量浓度的盐酸、硫酸反应,反应速率不相等 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 |
2.下列有关叙述错误的是( )
| A. | 化学反应均伴随着能量的变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 物质的化学能可以在一定条件下转化为热能、电能为人类利用 | |
| D. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 |
 已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图:
已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图: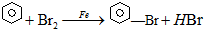 .;
.; 如图是初中化学中常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体;乙和丁为黑色固体.
如图是初中化学中常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体;乙和丁为黑色固体.