题目内容
【题目】根据问题填空:
(1)I.20mL0.1mol/LBaCl2溶液中Cl﹣的物质的量浓度为 , Ba2+的物质的量为 .
(2)II.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6LH2(标准状况下). ①合金中镁的物质的量 .
②写出该合金溶于足量NaOH溶液的化学方程式 . 同时产生H2的体积(标准状况下)为 .
(3)III.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则: 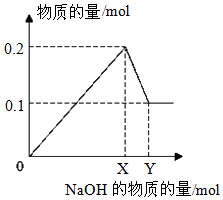
①生成Mg(OH)2的质量为;
②X=;Y= .
【答案】
(1)0.2mol/L;0.002mol
(2)0.1mol;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;3.36L
(3)5.8g;0.5;0.6
【解析】解:I.(1)20mL 0.1mol/LBaCl2溶液中Cl﹣的物质的量浓度为:c(Cl﹣)=2c(BaCl2)=0.1mol/L×2=0.2mol/L;
Ba2+的物质的量浓度为0.1mol/L,该溶液中含有钡离子的物质的量为:0.1mo/L×0.02L=0.002mol,
所以答案是:0.2mol/L;0.002mol;
II.①标准状况下,氢气的物质的量为 ![]() =0.25mol,
=0.25mol,
因盐酸足量,金属完全反应,设镁、铝的物质的量分别为x mol和y mol,则:
![]() ,解得x=0.1,y=0.1mol,故n(Mg)=0.1mol,n(Al)=0.1mol,
,解得x=0.1,y=0.1mol,故n(Mg)=0.1mol,n(Al)=0.1mol,
所以答案是:0.1mol;②镁和NaOH不反应,铝和NaOH溶液反应生成NaAlO2和H2,故方程式为 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
2Al+2NaOH+2H2O=2NaAlO2+ | 3H2↑ |
2 | 3 |
0.1 | 0.15 |
则:n(H2)=0.15mol,V(H2)=0.15mol×22.4L/mol=3.36L,
所以答案是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;3.36L;
III.①由图可知氢氧化镁的物质的量为0.1mol,所以质量为0.1mol×58g/mol=5.8g,
所以答案是:5.8g;
②由①分析得X的物质的量为0.1×2+0.1×3=0.5mol,Y的物质的量为:0.1mol的氢氧化铝消耗的氢氧化钠为0.1mol,所以Y的值为0.6mol,
所以答案是:0.5; 0.6.