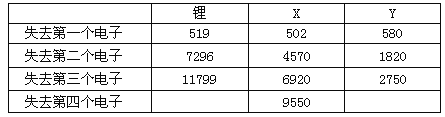
题目内容
【题目】锂-液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属银、熔融硫和多硫化锂分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列关于其说法错误的是
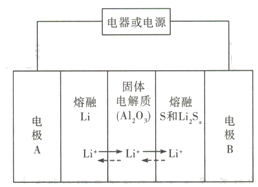
A. 放电时,电极B为正极
B. 充电时内电路中Li+的移动方向为从B到A
C. 该电池的适宜工作温度应该在Al2O3的熔点和沸点之间
D. 充电时,阳极反应为Sx2--2e-=xS
【答案】C
【解析】A. 放电时,A为原电池的负极,B为原电池的正极,选项A正确;B、充电时为电解池,B是阳极,A是阴极,Li+由B极向A极移动,选项B正确;C、硫和钠的熔、沸点较低,而是Al2O3高熔点,温度不易超过Al2O3的熔点,否则S或Li会气化,选项C错误;D、充电时,B是阳极,电极反应式为Sx2--2e-=xS,选项D正确。答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.
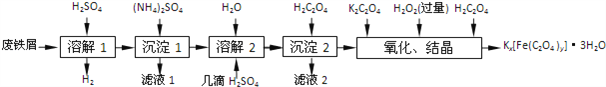
已知:(NH4)2SO4、FeSO47H2O、莫尔盐[(NH4)2SO4FeSO46H2O]的溶解度如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO47H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ |
(NH4)2SO4FeSO46H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)“溶解1”应保证铁屑稍过量,其目的是______.“溶解2”加“几滴H2SO4”的作用是______.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、______、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是______.
(3)“沉淀”时得到的FeC2O42H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是______.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是______.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4
步骤3:向步骤2所得溶液中______加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c molL﹣1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.