题目内容
(10分)使250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸跟铁屑充分反应。计算:
(1)此硫酸中H2SO4的物质的量浓度。
(2)生成H2的体积(标准状况)。
(3)将生成的硫酸亚铁配制成400 mL溶液,此溶液中硫酸亚铁的物质的量浓度是多少?
(1)此硫酸中H2SO4的物质的量浓度。
(2)生成H2的体积(标准状况)。
(3)将生成的硫酸亚铁配制成400 mL溶液,此溶液中硫酸亚铁的物质的量浓度是多少?
(1)2.75 mol·L-1
(2)15.4 L
(3)1.73 mol·L-1
(2)15.4 L
(3)1.73 mol·L-1
(1)c=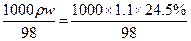 ="2.75" mol·L-1。
="2.75" mol·L-1。
(2)n(H2SO4)="2.75" mol·L-1×0.250 L="0.688" mol
根据Fe+H2SO4====FeSO4+H2↑即知生成的氢气也为0.688 mol,在标准状况下的体积为0.688 mol×22.4 L·mol-1="15.4" L。
(3)从(2)中可以求出硫酸亚铁也是0.688 mol,则c(FeSO4)= ="1.73" mol·L-1。
="1.73" mol·L-1。
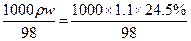 ="2.75" mol·L-1。
="2.75" mol·L-1。(2)n(H2SO4)="2.75" mol·L-1×0.250 L="0.688" mol
根据Fe+H2SO4====FeSO4+H2↑即知生成的氢气也为0.688 mol,在标准状况下的体积为0.688 mol×22.4 L·mol-1="15.4" L。
(3)从(2)中可以求出硫酸亚铁也是0.688 mol,则c(FeSO4)=
 ="1.73" mol·L-1。
="1.73" mol·L-1。
练习册系列答案
相关题目