题目内容
【题目】海洋是一个远未完全开发的巨大化学资源宝库。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
A 氯气 B 淡水 C烧碱 D 食盐
(2)从海水制得的粗盐中含有较多的Mg2+、Ca2+、SO![]() 等,要除去这些离子,下列加入药品顺序正确的是________(填序号)
等,要除去这些离子,下列加入药品顺序正确的是________(填序号)
A NaOH溶液→Na2CO3溶液→BaCl2溶液B BaCl2溶液→NaOH溶液→Na2CO3溶液
C NaOH溶液→BaCl2溶液→Na2CO3溶液D Na2CO3溶液 →NaOH溶液→ BaCl2溶液
(3)从海水中得到溴的过程如下:
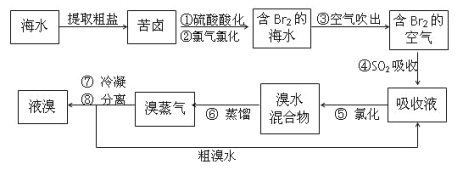
①写出由“苦卤”变成“含溴海水”的离子方程式________
②写出④发生反应的化学方程式________
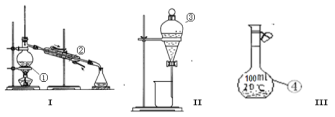
③某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图所示实验装置:
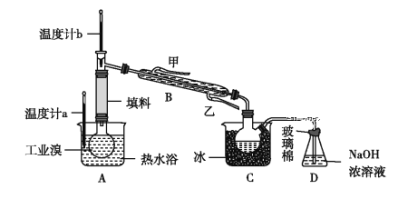
图中仪器B冷却水的出口为______(填“甲”或“乙”),D装置的作用是__________,反应的离子方程式为__________,整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
(4)已知某溶液中Cl-、Br-、I-的物质的量之比为2:3:4,现欲使溶液中的Cl-、Br-、I-的物质的量之比为变为4:3:2,那么通入Cl2的物质的量是原溶液中I-的物质的量的__________
【答案】BD BC Cl2+2Br-=Br2+2Cl- Br2+SO2+2H2O=2HBr+H2SO4 甲 吸收尾气 Br2 +2OH-=Br-+BrO-+H2O Br2能腐蚀橡胶 1/4
【解析】
(1)海水经过蒸发可得食盐,经过蒸馏可得淡水,都是物理变化。海水中氯以Cl-存在,要获得单质必须失电子才能实现,烧碱要电解饱和食盐水才可得到,发生了化学变化,所以本题答案为:BD;
(2)要除去Mg2+、Ca2+、SO![]() ,则用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,用碳酸钠溶液除去钙离子和剩余的钡离子,要先除硫酸根,然后再除钙离子,如果加反了,过量的钡离子就无法除去,至于除镁离子,可不受限制,因为过量的氢氧化钠加盐酸可除去,所以A、D中剩余的氯化钡无法除去,故本题答案为:BC;
,则用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,用碳酸钠溶液除去钙离子和剩余的钡离子,要先除硫酸根,然后再除钙离子,如果加反了,过量的钡离子就无法除去,至于除镁离子,可不受限制,因为过量的氢氧化钠加盐酸可除去,所以A、D中剩余的氯化钡无法除去,故本题答案为:BC;
(3)①“苦卤”中含有溴离子,变成“含溴海水”是用氯气氧化溴离子得到溴单质,离子方程式Cl2+2Br-=Br2+2Cl-,故本题答案为:Cl2+2Br-=Br2+2Cl-;
②步骤④是溴单质和二氧化硫发生了氧化还原反应,发生反应的化学方程式Br2+SO2+2H2O=2HBr+H2SO4,故本题答案为:Br2+SO2+2H2O=2HBr+H2SO4;
③冷凝管中冷却水的流向是下口进,上口出,应是乙口进,甲口出,进入D装置的物质为溴蒸汽,有毒,用碱液吸收挥发的溴单质,可防止污染环境,发生反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O,溴单质具有氧化性,可腐蚀橡胶,故整套装置中不能用橡胶塞和橡胶管,所以本题正确答案为:甲;吸收尾气;Br2+2OH-=Br-+BrO-+H2O;Br2能腐蚀橡胶;
(4)已知还原性I->Br->Cl-,反应后I-有剩余,说明Br-浓度没有变化,通入的Cl2只与I-发生反应,
设原溶液中含有2mol Cl-,3 mol Br-,4mol I-,通入Cl2后它们的物质的量之比变为4:3:2,则各离子物质的量分别为:4mol Cl-、3mol Br-、2mol I-,Cl-增加了2mol,则需1 mol Cl2,则通入的Cl2物质的量是原溶液中I-物质的量的1/4,故本题答案为:1/4。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
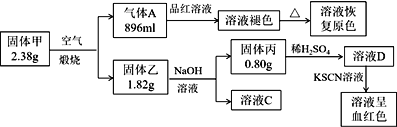
请回答:
(1)写出化合物甲的化学式________。
(2)写出形成溶液C的化学方程式:_____________。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)![]() CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1 ___0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2 初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
573 | 甲 | 40 | 50 |
573 | 乙 | 30 | 60 |
673 | 甲 | 55 | 35 |
673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K= _____。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图。_____