题目内容
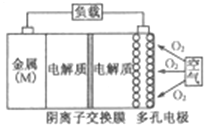
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
A.比较Mg、Al、Zn三种金属–空气电池,Mg–空气电池的理论比能量最高
B.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
C.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
D.在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用酸性电解质及阳离子交换膜
【答案】C
【解析】
试题分析:A、24g镁失去2mol电子,27g铝失去3mol电子,65g锌失去2mol电子,所以铝-空气电池的理论比能量最高,A错误;B、根据题给放电的总反应4M+nO2+2nH2O=4M(OH) n,氧气在正极得电子,由于有阴离子交换膜,正极反应式为O2+2H2O+4e–=4OH-,B错误;C、多孔电极可以增加氧气与电极的接触,使氧气充分反应,C正确;D、负极是金属失去电子生成金属阳离子,因为镁离子或铝离子或锌离子都可以和氢氧根离子反应生成氢氧化物沉淀,说明应采用中性电解质或阳离子交换膜,防止正极产生的氢氧根过来反应,D错误。答案选C。

练习册系列答案
相关题目