题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
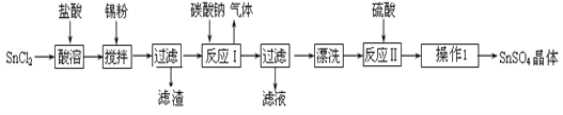
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2![]() Na2S2O5。
Na2S2O5。

(1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。
(2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。
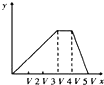
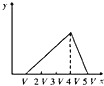
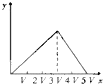
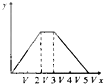
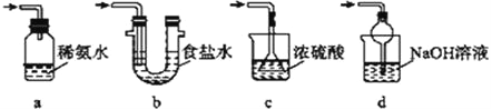
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O![]() H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。
【答案】 检查装置的气密性 Na2SO3+H2SO4(浓)== Na2SO4+SO2↑+H2O 不能 如用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出 过滤 d 0.192 偏低
【解析】(1)加试剂前要进行的操作是检查装置的气密性;装置Ⅰ中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,其化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;(2)如果用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出,所以不能用稀硫酸代替浓硫酸;(3)从装置Ⅱ中溶液中获得已析出的晶体,采取的方法是过滤;(4)装置Ⅲ用于处理尾气SO2,由于SO2属于酸性氧化物,除去尾气SO2应选择碱性溶液,a装置无气体出口,不利于气体与稀氨水充分接触,a不选;要选择d,既可有效吸收,又可防止倒吸,反应的方程式为2NaOH+SO2==Na2SO3+H2O;(5)①由题设滴定反应的化学方程式知,样品中抗氧化剂的残留量(以SO2计算)与I2的物质的量之比为1∶1,n(SO2)=n(I2)=0.01000mol·L-1×0.03L=0.0003mol,残留量=![]() =0.192g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2==2I2+2H2O,则用于与SO2反应的I2减少,故实验结果偏低。
=0.192g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2==2I2+2H2O,则用于与SO2反应的I2减少,故实验结果偏低。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案