题目内容
【题目】(1)白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
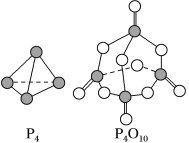
根据图示的分子结构和有关数据估算该反应的ΔH为 。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是 ;白磷的稳定性比红磷 (填“大”或“小”)。
【答案】(1)(6a+5d-4c-12b)kJ·mol-1(3分)
(2)红磷(2分) 小(2分)
【解析】(1)化学反应的实质是旧键断裂和新键形成,其中旧化学键断裂吸收能量,新化学键形成释放能量,化学方程式P4+5O2===P4O10中有6 mol P—P键和5 mol O===O键断裂,同时生成4 mol P===O键和12 mol P—O键,因此ΔH=(6a+5d-4c-12b)kJ·mol-1。
(2)依题意求:P4(白磷,s)===4P(红磷,s) ΔH=?可设计如下反应过程:P4(白磷,s)→P4O10(s)→4P(红磷,s);并把反应②改写成:P4O10(s)===4P(红磷,s)+5O2(g) ΔH3=-4ΔH2,据盖斯定律有ΔH=ΔH1+(-4ΔH2)=(-2 983.2+4×738.5)kJ·mol-1=-29.2 kJ·mol-1,即P4(白磷,s)===4P(红磷,s)
ΔH=-29.2 kJ·mol-1。白磷转化为红磷是放热反应,白磷稳定性比红磷小(能量越低越稳定)。